Guideline
Vorhofflimmern
Zuletzt revidiert: 03/2022 Letzte Änderung: 03/2022
Aktualisierung 03/2022
- Die Guideline wurde vollständig durchgesehen und an die Leitlinien der European Society of Cardiology (ESC) angepasst.
Abkürzungsverzeichnis
1. Wesentliche Neuerungen im Leitlinien-Update
Die aktuellen ESC-Leitlinien zum Management bei Vorhofflimmern (VHF) wurden im August 2020 veröffentlicht (1) – mit folgenden wesentlichen Änderungen
Abbildung 1: Management des VHF –> „CC to ABC“ Diagnose- und Therapiealgorithmus
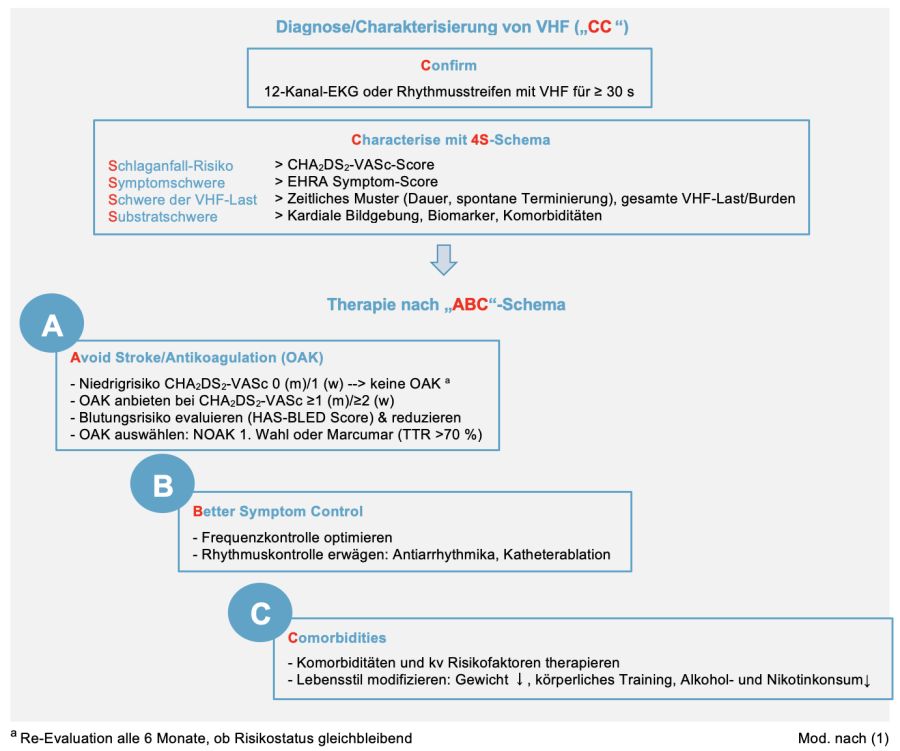
- „CC – confirm and characterise“-Diagnosealgorithmus
- Zur Sicherung der Diagnose wird ein 12-Kanal- oder 1-Kanal-EKG mit über 30 sec anhaltendem VHF gefordert (IB)
- Neue Technologien (Wearables wie Smartwatch oder Smartphone-Apps) werden in der Leitlinie als Option zur Arrhythmie-Detektion berücksichtigt – aber mit Hinweis, dass eine durch Algorithmen automatisch gestellte Diagnose nicht anerkannt ist, sondern das VHF von einem Arzt im EKG verifiziert werden muss
- AHRE (Atrial High Rate Episodes) wurden als neue Entität in die Leitlinien aufgenommen, sinngemäss einer subklinischen VHF-Vorstufe, die aber bereits mit leicht erhöhtem Schlaganfallrisiko einhergehen kann
- Mit dem neuen „4S-AF“-Schema (2) soll das VHF nach Diagnosestellung mit Blick auf Behandlung, deren Erfolgsaussichten und Prognose strukturiert analysiert werden (IIaC)
- Schlaganfall-Risiko –> kalkuliert mit dem CHA2DS2-VASc-Score
- Symptom-Schweregrad –> bestimmt anhand des EHRA-Scores als Auswirkung des VHF auf die Lebensqualität des Patienten
- Schwere der VHF-Last –> nach zeitlichem Verlauf und Dauer (paroxysmal, persistierend, permanent) abgeschätzte oder mittels Monitoring dokumentierte „Arrhythmielast“
- Substrat-Schweregrad als strukturelle und funktionelle Basis der Arrhythmie –> Evaluation über kardiale Bildgebung (Echo, evt. MRT)/Biomarker und Erfassung der Komorbiditäten.
- „ABC – Atrial fibrillation Better Care“ – als interdisziplinärer Behandlungsalgorithmus (IIaB) (3)
- A (Anticoagulation/Avoid stroke) steht für die Notwendigkeit einer Antikoagulation zur Schlaganfall-Prophylaxe, mit Ausnahme von Patienten mit niedrigem Risiko. Voraussetzung für die Entscheidung über eine Antikoagulation ist die Bestimmung des Strokerisikos mittels CHA2DS2-VASc-Score (IA) und Beurteilung des Blutungsrisikos anhand des HAS-BLED-Scores (IIaB). Die daraus abgeleiteten Empfehlungen zur OAK wurden gegenüber der vorgängigen Leitlinie nicht verändert
- B (Better symptom management) steht für eine bei ausgeprägten Symptomen und eingeschränkter Lebensqualität zusätzlich erforderliche frequenzkontrollierende oder rhythmuserhaltende Therapie mit Medikamenten oder Katheterablation
- C (Cardiovascular and Comorbidity optimisation) bezeichnet eine ergänzend erforderliche Optimierung von Komorbiditäten und kardiovaskulären Risikofaktoren inkl. einer Lifestyle-Modifikation bei Übergewicht/Fettleibigkeit, Rauchen, Bewegungsmangel.
- Aufwertung der Katheterablation in den neuen Leitlinien
- Bei Patienten mit VHF und hoher Wahrscheinlichkeit für eine Tachykardie-induzierte Kardiomyopathie als Ursache einer eingeschränkten LV-Funktion hat die Ablation den Status einer First-line-Therapie mit einer Klasse-I-Empfehlung erhalten (vorher IIaC)
- Neu ist die Empfehlung, dass bei ausgewählten Patienten mit Herzinsuffizienz mit erniedrigter Auswurffraktion (HFrEF) symptomunabhängig eine Ablation zur Reduktion von Mortalität und Klinikaufenthalten wegen Herzinsuffizienz in Betracht gezogen werden sollte (Klasse-IIa-Empfehlung).
Die Empfehlungen reflektieren die Ergebnisse grosser randomisierter Studien, die prognostisch relevante Behandlungsvorteile für eine symptomunabhängige Katheterablation bei VHF mit Einschränkung der LVEF im Vergleich zur medikamentösen Therapie zeigen konnten ([4, 5]).
2. Epidemiologie, Risikofaktoren/Ursachen
2.1. Epidemiologie und Auswirkung
- VHF ist die häufigste Herzrhythmusstörung, die Prävalenz steigt mit dem Alter (im 5. Dezennium bis 1 %, 6. Dez. ca. 5 %, 7. Dez. bis 15 %). Das Lebenszeitrisiko von heute 55-Jährigen beträgt etwa 30 %, wobei bei den vorhandenen epidemiologischen Daten nicht ganz klar definiert ist, welcher Anteil der erfassten VHF Prävalenzen auch wirklich klinische Relevanz hat (6)
- VHF ist mit erhöhter kardiovaskulärer Morbidität und Mortalität verbunden (1)
- Apoplex Risiko: 6-fach erhöht, 20–30 % aller ischämischen, 10 % der kryptogenen Schlaganfälle
- Herzinsuffizienz: 20–30 % der Patienten mit VHF entwickeln eine LV-Dysfunktion
- Hospitalisationsrate von Patienten mit VHF liegt bei 10–40 %/J.
- Mortalitätsrate: 1,5–3,5-fach erhöht.
2.2. Risikofaktoren/Ursachen
Das Risiko für VHF erhöht sich insbesondere bei Begleiterkrankungen/-umständen mit hämodynamischer oder mechanischer Vorhofbelastung.
- Kardiovaskulär
- Hypertonie
- Herzinsuffizienz
- KHK/Myokardinfarkt
- Herzklappenerkrankung
- Kardiomyopathie
- Sick-Sinus-Syndrom
- Myo-/Perikarditis
- Nach herzchirurgischen Eingriffen.
- Extrakardial
- Schilddrüsen-Dysfunktion, Elektrolytstörung, chronische Niereninsuffizienz, Diabetes
- Infekte
- Alkoholkonsum („holiday-heart-syndrome“), Drogen (v. a. Kokain)
- COPD, Schlafapnoe
- Übergewicht
- Körperliche Inaktivität/intensiver Sport
- Lungenembolie, Thoraxtrauma.
3. Diagnose und Klassifikation
3.1. Klinische Symptomatik
- Abhängig von Dauer des VHF und Ventrikelfrequenz sowie individueller Wahrnehmung
- Palpitationen, Thoraxschmerz
- Schwindel, Prä-/Synkope
- Belastungsintoleranz, Müdigkeit, Dyspnoe u./o. weitere klinische Zeichen einer Herzinsuffizienz.
Zur Quantifizierung von VHF-Symptomen wird der Einsatz der modifizierten EHRA*-Klassifikation (7) vor und nach Beginn der Behandlung empfohlen (IC)

Cave: VHF kann asymptomatisch sein (ca. 70 % Anteil von „stillen“ vom Patienten nicht wahrgenommen Flimmerepisoden) und sich erst mit einer konsekutiven Komplikation wie einem Schlaganfall als 1. klinischen Erscheinungsbild äussern.
3.2. EKG-Diagnostik und Screening (1)
- Indikation
- Für ein breites Screening auf VHF besteht gemäss USPSTF-Empfehlung 2022 keine Evidenz bei asymptomatischen Erwachsenen über 50 Jahre. Die ESC-Guidelines empfehlen ein sog. opportunistisches, d. h. auf Patienten mit Risikoindikatoren (vgl. 2.2.) bezogenes Screening auf VHF > 65 J. mit gelegentlicher Pulsmessung oder EKG (IB). Neuere Studien stellen aber selbst bei > 75-Jährigen für VHF-gefährdeten Patienten ein Screening in Frage, da unter Antikoagulation nach Detektion von VHF keine signifikante Verbesserung der Schlaganfallrate zu beobachten war (39, 40)
- Nach akutem ischämischem Schlaganfall oder TIA, ohne vorher bekanntes VHF: EKG-Monitoring für die ersten 24 h, wenn möglich gefolgt von einem LZ-EKG über mind. 72 h (IB)
- Bei kryptogenem Schlaganfall zusätzliche EKG-Überwachung durch langfristige nichtinvasive oder implantierte Ereignisrekorder (IIaB). Nicht alle Schlaganfallpatienten profitieren von einer verlängerten EKG-Überwachung, wird nur für ausgewählte Patienten empfohlen mit erhöhtem Risikopotential für VHF
- Schlaganfallcharakteristika in der Bildgebung, die auf embolischen Schlaganfall hindeuten
- Ältere Patienten mit kardiovaskulären Risikofaktoren oder Komorbiditäten, Indizes für LA-Remodeling. Hinweise auf ein Remodeling sind z. B. im Echo eine Vergrösserung des linken Vorhofs oder Zeichen einer hypertensiven Herzerkrankung
- Hoher C2HEST-Score (8): KHK/COPD (je 1 Punkt), Hypertonie (1 Punkt), ältere Menschen (≥ 75 J., 2 Punkte), systolische Herzinsuffizienz (2 Punkte) und Schilddrüsenerkrankung/Hyperthyreose (1 Punkt).
- Klinisches VHF ist definiert als a- oder symptomatische Episoden irregulärer RR-Intervalle ohne erkennbare P-Wellen, dokumentiert in einem Oberflächen-EKG in einer 1-Kanal-EKG-Ableitung mit Mindestdauer von 30 sec oder über ein vollständiges 12-Kanal-EKG (IB)
- Subklinisches VHF liegt vor, wenn bei symptomlosen Personen im Speicher von PMs oder ICDs, einem implantierten Herzmonitor oder über Wearables Arrhyhthmien erfasst werden, die nach ärztlicher Prüfung als VHF bestätigt sind
- AHRE (atrial highrate episodes) sind im intrakardialen Monitoring von PMs oder ICDs aufgezeichnete atriale Hochfrequenzepisoden (> 175/min), ohne VHF-typische Symptome, das Kriterium für die Dauer der AHRE wird normalerweise auf ≥ 5 min festgelegt (v. a. um den Einschluss von Artefakten und falsch-positiven Episoden zu verringern, z. B. durch Oversensing, sondeninduzierte Arrhythmien oder andere externe Störpotentiale)
- Evaluationsstudien mit Smartphone-Apps und Smartwatches zeigen eine zum Teil sehr gute Sensitivität und Spezifität (9, 10) und haben dazu geführt, dass der Zusatznutzen der Wearables in der neuen Leitlinie zum Screening anerkannt wurde. Allerdings handelt es sich dabei oft nur um kleine Beobachtungsstudien, weshalb die Diagnose VHF unter Vorbehalt erst dann gestellt werden darf, wenn sie von einem Arzt im 12-Kanal-Ruhe-EKG oder 30 sec-Rhythmusstreifen (auch akzeptiert über den Rhythmusstreifen aus dem 1-Kanal-EKG einer Smartwatch) verifiziert wurde.
- Typen von Vorhofflimmern
VHF tritt anfänglich meist in kurzen selbstlimitierenden Episoden auf, meistens kommt es im Verlauf zum Fortschreiten der Erkrankung und anhaltenden Formen

3.3. Weitere Diagnostik
- Klinischer Status und Erfassung von Begleiterkrankungen (IC) –> vgl. Abschnitt 2.2.
- Befragung auf klinische Anzeichen für das obstruktive Schlafapnoe-Syndrom (IIaB)
- Labor: Hämatogramm, Elektrolyte, TSH, Nierenretentionswerte
- Echokardiographie: Sollte bei allen Patienten mit detektiertem VHF durchgeführt werden (IC).
4. „ABC“-Behandlungsalgorithmus
Der in der Leitlinie neu eingeführte ABC-Pfad (Atrial fibrillation Better Care) soll strukturiert über die Säulen
- „A“ Antikoagulation/Schlaganfallprophylaxe
- „B“ Bessere Symptomkontrolle
- „C“ Kardiovaskuläre Risikofaktor- und Komorbiditätsoptimierung
eine ganzheitliche Behandlung von Patienten mit VHF über alle Ebenen der Gesundheitsversorgung und den verschiedenen Fachbereichen gewährleisten.
Verglichen mit der üblichen Versorgung ist die Umsetzung des ABC-Pfades mit einem signifikant geringeren Risiko für klinische Ereignisse verbunden (3).
4.1. „A“ – Antikoagulation
- VHF ist für ca. 20–30 % aller Schlaganfälle verantwortlich, insbesondere für schwere, invalidisierende Insulte, mit hohem Rezidivrisiko
- OAK kann die Schlaganfallrate bei VHF um fast 70 % vermindern (11). Die verbleibende ischämische Insultrate liegt in Vergleichsstudien unter VKA bei 1,60–2,42 %/Jahr, für die NOAKs (Rivaroxaban, Dabigatran, Apixaban) bei 1,11–2,12 %/Jahr (12), bei einem besseren Sicherheitsprofil.
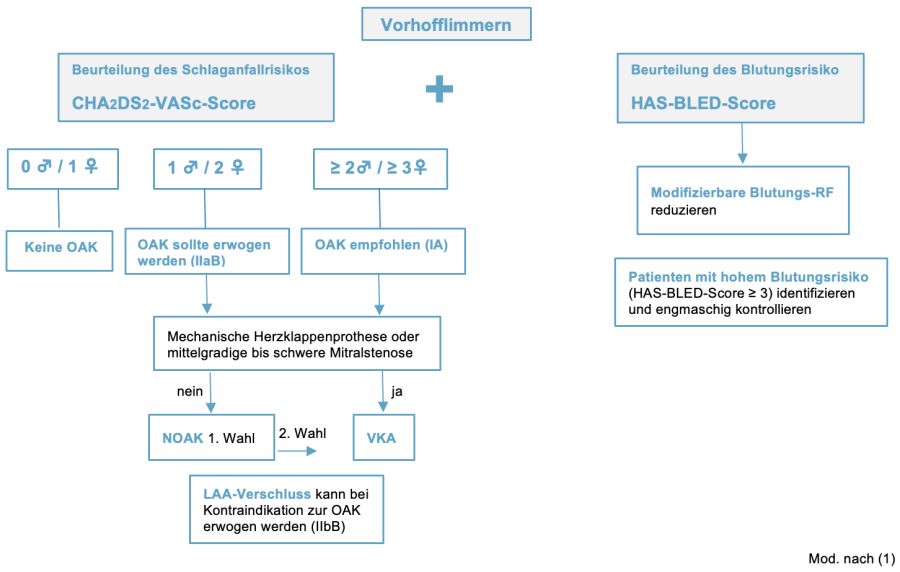
Abbildung 2: Thrombembolie-Prophylaxe bei Vorhofflimmern
4.1.1. Beurteilung des Schlaganfallrisikos mit dem CHA2DS2-VASC-SCORE
Der auf klinischen Risikofaktoren basierende CHA2DS2-VASc-Score (13) wird zur Beurteilung des Schlaganfall-Risikos bei VHF empfohlen (I A)
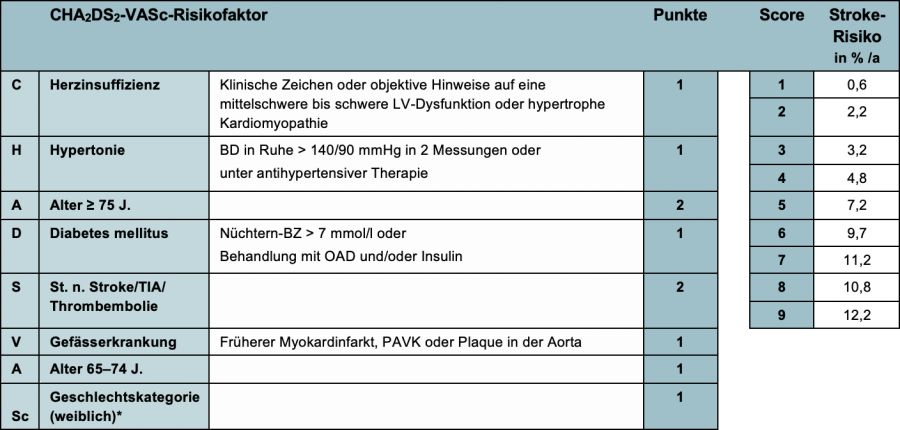
* Das weibliche Geschlecht wurde in einigen Leitlinien als Risikofaktor bereits herausgenommen, nachdem in Metaanalysen bei Frauen mit VHF ohne weitere Risikofaktoren das Schlaganfallrisiko nicht erhöht ist. In der neuen ESC-Leitlinie wird daran festgehalten. Begründet wird die Entscheidung damit, dass wesentliche Studien zur Antikoagulation bei VHF mit dem CHA2DS2-VASc-Score (also mit Gender als RF) durchgeführt wurden.
- Therapieentscheidung für eine OAK anhand des CHA2DS2-VASc-Scores (s. Abbildung 2)
- Männer ♂ mit Score 0 / Frauen ♀ ohne weiteren RF haben ein niedriges Schlaganfallrisiko und benötigen keine OAK (IA)
- Bei initial niedrigem Schlaganfallrisiko sollte nach 4–6 Monaten eine Reevaluation erfolgen, da Risikofaktoren häufig erst nach Erstdiagnose von VHF festgestellt werden (IIaB)
- Bei Vorliegen 1 Risikofaktors für thrombembolische Ereignisse (Score bei ♂ 1 / ♀ 2) soll eine OAK unter Berücksichtigung des klinischen Nettonutzens und Patientenpräferenz individuell erwogen werden (IIaB)
- Bei ♂ mit Score ≥ 2 / ♀ ≥ 3 Punkte und damit erhöhtem thromboembolischen Risiko soll eine OAK erfolgen (IA)
- Bei getriggert neu aufgetretenem, auch bei transienten VHF wird initial die gleiche Vorgehensweise und Entscheidung zur Antikoagulation nach dem CHA2DS2-VASc-Score empfohlen. Die Empfehlung zur Antikoagulation bei postoperativ erstdiagnostizierten VHF (IIaB) resultiert aus der Erkenntnis, dass bei diesen Patienten häufig doch ein arrhythmogenes Substrat und Vorhofschädigung präexistent und mit einem im Verlauf über 5 Jahre 4–5-fach erhöhtem Rezidiv- (14) sowie erhöhtem Strokerisiko assoziiert ist (15, 16). Elektrolytstörungen, eine gestörte Glucosehomöostase, hormonelle Dysfunktion (z. B. Hyperthyreose) oder Infekt können ebenfalls VHF begünstigen. Auch hier wird zunächst eine Antikoagulation nach CHA2DS2-VASc-Score-Risikostratifikation empfohlen, allerdings sind Daten zum Management in diesen Situationen nur begrenzt verfügbar. Nach 3–6 Monaten kann in Kenntnis der kardialen Gesamtsituation und Komorbiditäten eine Reevaluation erfolgen.
- Vorhofflattern: Eine OAK wird analog desselben Risikoprofils wie bei VHF empfohlen (IB)
- Sonderfall: Subklinisches VHF (SCAF)/AHRE (vgl. 3.2.) –> Frage der klinischen Relevanz/therapeutischen Konsequenz
- Patienten mit AHRE haben ein durchschnittlich 2,1–2,4-fach erhöhtes Schlaganfallrisiko, das hauptsächlich von der Dauer der längsten AHRE-Episoden bestimmt zu sein scheint. Bei einer Dauer < 5 min ist es nicht relevant erhöht, bei > 24 h deutlich und in der gleichen Grössenordnung wie bei dauerhaftem VHF (17)
- Basierend auf diesen Daten, soll gemäss ESC-Leitlinien bei Patienten mit einer AHRE/SCAF-Last von ≥ 24 h Dauer und einem hohen Schlaganfallrisiko mit einem CHA2DS2-VASc-Score von ≥ 2 (m) und ≥ 3 (w) eine Antikoagulation in Betracht gezogen werden
- Bei geringerer Dauer bzw. niedrigerem CHA2DS2-VASc-Score wird eine regelmässige Überwachung empfohlen, um das Fortschreiten zu klinischem VHF oder Zunahme der AHRE/SCAF-Last auf ≥ 24 h zu erkennen (IB) und dann eine OAK zu erwägen
- Modifizierbare Schlaganfallrisikofaktoren sollen identifiziert und behandelt werden.
- Auswahl des Antikoagulans für Schlaganfall-Prävention
- NOAK werden bei Neueinstellungen als Antikoagulantien der 1. Wahl bei VHF empfohlen (IA)
- VKA werden bei mittelgradiger bis schwerer Mitralklappenstenose oder mechanischen Herzklappen eingesetzt (IB), die NOAK sind hier kontraindiziert
- Wenn mit VKA behandelt wird, sollte die Zeit im therapeutisch wirksamen Bereich (TTR, INR 2–3) so gross wie möglich (≥ 70 %) gehalten und genau überwacht werden (IB). Ansonsten Wechsel auf ein NOAK.
Siehe hierzu auch mediX GL Neue/direkte orale Antikoagulantien.
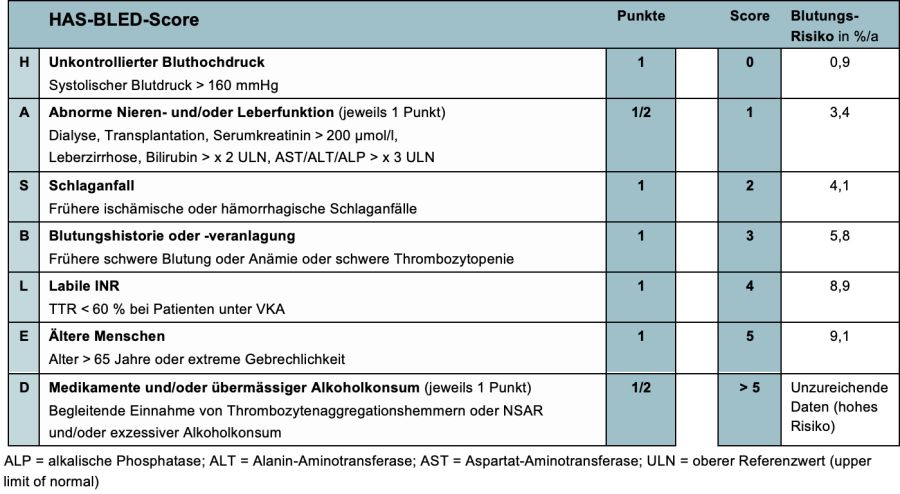
4.1.2. Beurteilung des Blutungsrisikos
- Zur Bewertung des Blutungsrisikos unter OAK wird eine strukturierte, auf einem Risikoscore basierende Beurteilung empfohlen (IB) z. B. der HAS-BLED-Score (18), um
- Patienten mit höherem Blutungsrisiko (HAS-BLED-Score ≥ 3) zu identifizieren und für häufigere klinische Überprüfung und Nachsorge einzuplanen (IIaB)
- Ein hoher Blutungs-Risikoscore sollte aber nicht dazu führen, dem Patienten eine indizierte OAK vorzuenthalten, sondern dafür sensibilisieren, behandelbare Faktoren zu korrigieren.
4.1.3. LAA-Verschluss mittels Vorhofohroccluder (19–22)
- Indikation
Thromben, welche beim VHF embolisieren, entstehen zu 90 % im linken Vorhofohr (LAA). Daher kann der interventionelle LAA-Verschluss bei Kontraindikation für eine OAK (z. B. nach relevanter Blutung unter OAK ohne reversible Ursache) als Alternative erwogen werden (IIbB) - Komplikationen der Intervention
- Periprozedural: Perikarderguss/-tamponade (1 %). Embolisation des Occluders (1 %). Schlaganfall, TIA (0,5 %). Blutung an Einstichstelle (2 %). Vaskuläre Komplikationen (< 0,5 %)
- Mittelfristig: Thrombusbildung auf Occluder (3–5 %). Kleiner residueller ASD (11 %).
- Nachbehandlung (1)
- Antithrombotische Therapie: Beste Nachbehandlung nach LAA-Verschluss noch nicht eindeutig geklärt, da die antithrombotische Therapie in den Zulassungsstudien der Devices sehr inhomogen war. Üblicherweise erfolgt in ersten 1–6 Monaten (Endothelialisierungsphase) eine duale Plättchenhemmung (DAPT) mit ASS + Clopidogrel, dann ASS-Monotherapie auf Dauer. Bei sehr hoher Blutungsgefahr DAPT für 3 Monaten, anschliessend keine spezifische Therapie (falls keine KHK vorliegt). Im Zweifel ist eine Rücksprache mit dem Katheterlabor empfohlen
- Endokarditisprophylaxe für 6 Monate nach der Implantation des Occluders.
4.2. „B“ – Bessere Symptomkontrolle
Die beiden Hauptkonzepte sind hierbei die Frequenz-regulierende und die Rhythmus-kontrollierende Therapie.
- Erstere gilt als Basistherapie und Therapie 1. Wahl bei Patienten ohne oder mit nur geringen Symptomen
- Eine Rhythmuskontrolle oder AV-Knoten-Ablation ist zu erwägen, wenn Symptome fortbestehen oder eine Tachymyopathie (= Einbusse der LVEF wegen Tachykardie) auftritt.
4.2.1. Frequenzregulierende Therapie
- Initial sollte eine moderate Frequenzkontrolle angestrebt werden: Ziel: Ruhe-HF < 110/min (IIaB). Die Empfehlung basiert u. a. auf Daten der RACE-, RACE II- sowie AFFIRM-Studie (23–25), wobei der Zielwert kontrovers diskutiert wird
- Striktere Frequenzkontrolle wird empfohlen bei persistierenden Symptomen oder wenn trotz Frequenzreduktion eine Verschlechterung der LV-Funktion auftritt. Ziel ist dann eine Ruhe-HF < 80/min und < 110/min bei moderater Belastung
- Bradykardien unter antiarrythmischer Therapie sollen vermieden werden (IB)
- Die Auswahl der Frequenz-regulierenden Therapie wird von den Komorbiditäten bestimmt
- Betablocker sind Medikamente 1. Wahl zur HF-Kontrolle bei VHF, unabhängig der systolischen Ventrikelfunktion, auch bei reduzierter LVEF < 40 % (IB). Limitiert ist der Einsatz bei Atemwegserkrankungen: Bei schwerer COPD und schwerem Asthma sollen nur Beta1-selektive Medikamente eingesetzt werden, alternativ NDCCB (vorausgesetzt LVEF ≥ 40 %) oder als Zweitlinientherapie Digoxin (auch bei LVEF < 40 % möglich). Bei leichter oder gut eingestellter COPD oder Asthma sind Beta1-unselektive Betablocker in der Regel unproblematisch
- Beta1-selektiv
- Atenolol: 25−100 mg
- Bisoprolol: 1,25–10 mg (bis max. 20 mg im Einzelfall) 1 x tgl. oder geteilt
- Metoprolol: 100–200 mg 1 x tgl.
- Nebivolol: 2,5–10 mg 1 x tgl. oder geteilt
- Carvedilol: 3,125–50 mg 2 x tgl. (nicht-selektiv).
- Beta1-selektiv
- Nicht-Dihydropyridin-Kalziumantagonisten (NDCCB) sind ebenfalls Erstlinientherapie zur HF-Kontrolle bei VHF, Bedingung LVEF ≥ 40 % (IB)
- Diltiazem: 60 mg 3 x tgl., bis max. 360 mg/d (120–360 mg in Retardgalenik 1 x tgl.)
- Verapamil: 40–120 mg 3 x tgl. (120–480 mg in Retardgalenik 1 x tgl.).
- Herzglykoside werden bei VHF mit einer LVEF < 40 % zur HF-Regulierung als Zweitlinientherapie oder als Kombinationspartner bei noch suboptimaler HF-Kontrolle empfohlen (IB)
- Digoxin: 0,125–0,25 mg 1 x tgl.
Cave: Labor-Kontrollen, hohe Plasmaspiegel in Beobachtungsstudien mit erhöhter Mortalität assoziiert.
- Digoxin: 0,125–0,25 mg 1 x tgl.
- Amiodaron hat seine Indikation primär im Bereich der Rhythmuskontrolle zur Regularisierung von VHF; kann aber als weitere, untergeordnete Option bei ungenügender HF-Kontrolle in Kombinationstherapie eingesetzt werden
- Initiale Stossbehandlung: 600 mg/d für die Dauer von 8 bis 10 d
- Erhaltungsdosis: 100 mg bis 400 mg/d.
- Betablocker sind Medikamente 1. Wahl zur HF-Kontrolle bei VHF, unabhängig der systolischen Ventrikelfunktion, auch bei reduzierter LVEF < 40 % (IB). Limitiert ist der Einsatz bei Atemwegserkrankungen: Bei schwerer COPD und schwerem Asthma sollen nur Beta1-selektive Medikamente eingesetzt werden, alternativ NDCCB (vorausgesetzt LVEF ≥ 40 %) oder als Zweitlinientherapie Digoxin (auch bei LVEF < 40 % möglich). Bei leichter oder gut eingestellter COPD oder Asthma sind Beta1-unselektive Betablocker in der Regel unproblematisch
- Ultima ratio bei Nichtansprechen (oder Unverträglichkeit) der medikamentösen Therapie zur HF-Kontrolle und persistierenden Beschwerden: AV-Knoten-Ablation mit Schrittmacherversorgung (IIaB)
Abbildung 3: Auswahl der Frequenz-regulierenden Therapie
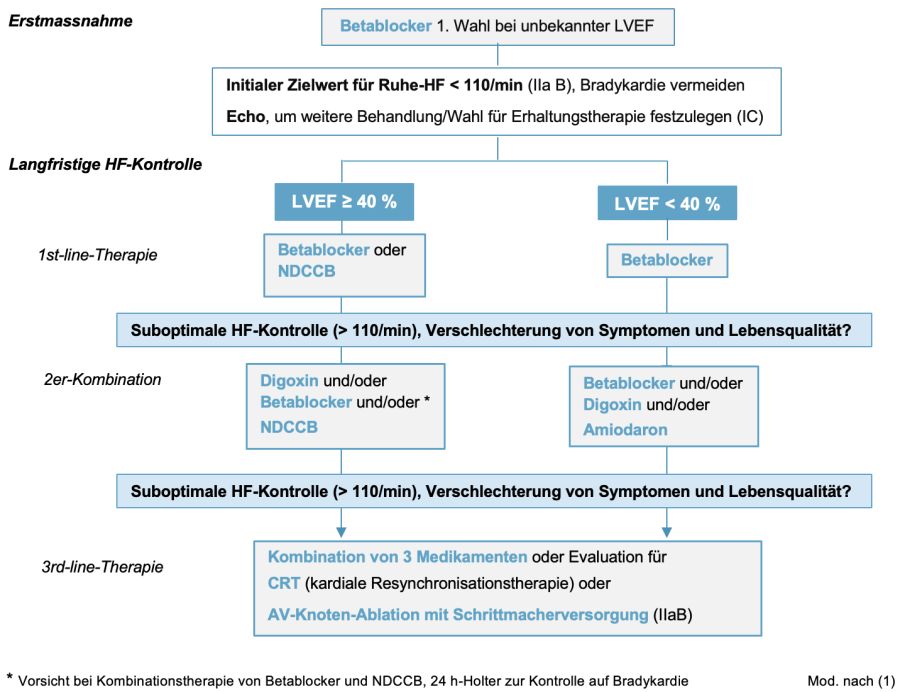
4.2.2. Rhythmus-Kontrolle
- Massnahmen zur Wiederherstellung des Sinusrhythmus sind elektrische oder medikamentöse Kardioversion durch Antiarrhythmika sowie die Katheterablation
- Primäre Indikation zur Rhythmus-Kontrolle ist die Verringerung der VHF-bezogenen Symptome und die Verbesserung der Lebensqualität (IA), wenn mittels einer Frenquenzkontrolle nicht der gewünschte Effekt erzielt werden konnte
- Es wird anhand neuerer Studien mit signifikanter Reduktion im primären Endpunkt (kardiovaskulärer Tod, Schlaganfälle, Verschlechterung der Herzinsuffizienz oder akute Koronarsyndrome) zugunsten der frühen Rhythmuskontrolle diskutiert, ob und bei wem eine Rhythmus- gegenüber einer reinen Frequenzkontrolle auch allenfalls bei asymptomatischen Patienten vorgezogen werden sollte (26). Generelle Empfehlungen hierfür bestehen jedoch noch nicht
- Faktoren, die einen Rhythmus-Erhalt begünstigen (1)
- Jüngeres Alter
- VHF-Episode oder kurze VHF-Dauer
- Tachykardie-vermittelte Kardiomyopathie
- Keine oder wenige Begleiterkrankungen/Herzerkrankung
- Schwierige Frequenzregulierung
- Durch ein vorübergehendes Ereignis (Akuterkrankung) ausgelöstes VHF
- Patientenwunsch
Kardioversion
- Vorbehandlung – OAK-Status zur elektrischen/medikamentösen Kardioversion
- Vorgängig der Kardioversion wird eine 3-wöchige wirksame Antikoagulation empfohlen (IB)
- Alternativ präprozedural Ausschluss kardialer Thromben mittels TEE (IB)
- Bei Nachweis intrakardialer Thromben im TEE, wird eine Antikoagulation für mind. 3 Wochen empfohlen (IB) und sollte vor der Kardioversion eine TEE-Kontrolle erwogen werden, um sich der Auflösung des Thrombus zu vergewissern (IIaC)
- Bei einer VHF-Dauer < 48 h kann eine frühe Kardioversion ohne TEE durchgeführt werden (IIaB)
- Eine medikamentöse Kardioversion als „Pill-in-the-pocket“-Behandlung bedarf bei Patienten mit niedrigem CHA2DS2-VASc-Score keiner periprozeduralen Antikoagulation.
- Nachbehandlung
- Nach erfolgreicher Kardioversion soll die Antikoagulation für mind. 4 Wochen fortgesetzt werden (IIaB) oder bei gemäss CHA2DS2-VASc-Score Schlaganfall-Gefährdeten langfristig, ungeachtet der Kardioversionsmethode oder der scheinbaren Erhaltung des Sinusrhythmus (IB)
- Bei einer definitiven VHF-Dauer ≤ 24 h und sehr geringen Schlaganfallrisiko (CHA2DS2-VASc von 0 bei Männern oder 1 bei Frauen) kann auf die 4-wöchige OAK nach Kardioversion verzichtet werden (IIbC).
- Medikamentöse Kardioversion
- Indikation: Persisitierendes symptomatisches VHF, bei hämodynamisch stabilen Patienten, nach Abwägung des thromboembolischen Risikos (IB)
- Eine Kardioversion mit Antiarrythmika ist am effektivsten, wenn das VHF erst kurz besteht. Wenn die Therapie innerhalb von 7 d nach Auftreten der Arrhythmie begonnen wird, kann mit einer Erfolgsrate von 50–70 % zur Wiederherstellung des SR gerechnet werden. Dem entgegenzusetzen ist die damit oft einhergehende Notwendigkeit einer langfristig rhythmuserhaltenden Therapie, siehe dazu Kapitel 4.2.3.
- Bei Sick-Sinus-Syndrom, atrioventrikulären Überleitungsstörungen oder verlängerter QTc (> 500 ms) wird eine pharmakologische Kardioversion nicht empfohlen, es sei denn, die Risiken für Proarrhythmie und Bradykardie werden berücksichtigt und gemonitored (IIIC)
- Die Wahl des Antiarrhythmikums hängt von der zugrunde liegenden Herzerkrankung ab und wird üblicherweise unter Monitoring intravenös appliziert. Im ambulanten Setting sind hierfür lediglich 2 Methoden von Bedeutung
- „Pill-in-the pocket“-Prinzip als Patienten-geführte Kardioversion
- Indikation: Für ausgewählte Patienten ohne relevante strukturelle oder ischämische Herzerkrankung mit symptomatischem VHF, das akut, aber selten auftritt (max. 1 x/Monat) orale Einzeldosis von Flecainid (200–300 mg) oder Propafenon (450–600 mg) (IIaB)
- Vorgängig: Sicherheitsbewertung der Therapie unter ärztlicher Beobachtung vor Anwendung des Patienten in Eigenregie
- Wirkung: Bei oraler Gabe in ca. 4 h, Konversionserfolg 70–80 %
- Kontraindikation: Herzinsuffizienz, KHK/St. n. Myokardinfarkt, signifikante LVH.
- Amiodaron
- Indikation: Bei Patienten mit ischämischer und/oder struktureller Herzerkrankung wird Amiodaron zur Kardioversion des VHF empfohlen (IA)
- Dosierung: Initial 600 (–800–1‘000) mg tgl. über 8–10 d, dann Erhaltungsdosis von 100–400 mg/d
- Vorteil: Sicherstes Antiarryhtmikum für Patienten mit struktureller Herzerkrankung und eingeschränkter LVEF, geringe Proarrhythmie
- Nachteil: Nebenwirkungsreich in der Langzeitanwendung: Lungentoxisch (Hypersensitivitäts-Pneumonitis, Lungenfibrose, Bronchiolitis obliterans/BOOP), Photosensibilisierung (wichtig: Ausreichender Sonnenschutz unter Therapie), Augenerkrankung (Ablagerungen auf der Cornea, Optikusneuritis, Makuladegeneration), Schilddrüsen-Funktionsstörung, extrapyramidaler Tremor
- Wirkung: Konversionserfolg 45–68 %.
- „Pill-in-the pocket“-Prinzip als Patienten-geführte Kardioversion
- Elektrische Kardioversion (EKV)
- Indikation: Akutbehandlung bei hämodynamischer Instabilität (IB). Elektive EKV bei persistierender Symptomatik unter VHF trotz medikamentös antiarrhythmischer Therapie
- Wirkung: Mit einer Elektrokardioversion gelingt bei bis zu 90 % der Patienten eine initiale Konversion in den SR (27). Eine Vorbehandlung mit Antiarrhythmika (Amiodaron, Flecainid, Propafenon oder Ibutilid) erhöht den Erfolg einer EKV (IIaB). Durchschnittlich sind nach 1 Jahr etwa 50 % der Patienten weiterhin im SR. Mit Antiarrhythmika zur Stabilisierung des Herzrhythmus liegt die Erfolgsrate nach 1 Jahr bei etwa 70 % (siehe Kapitel 4.2.3.). Eine randomisierte Studie zum Erfolgsvergleich elektrischer versus pharmakologischer Kardioversion liegt nicht vor
- Risiken und Komplikationen: Sind primär assoziiert mit thrombembolischen Ereignissen, Arrhythmien und den Risiken der Narkose.
4.2.3. Langfristige Antiarrhythmika (AAD)-Therapie zur Rhythmus-Erhaltung
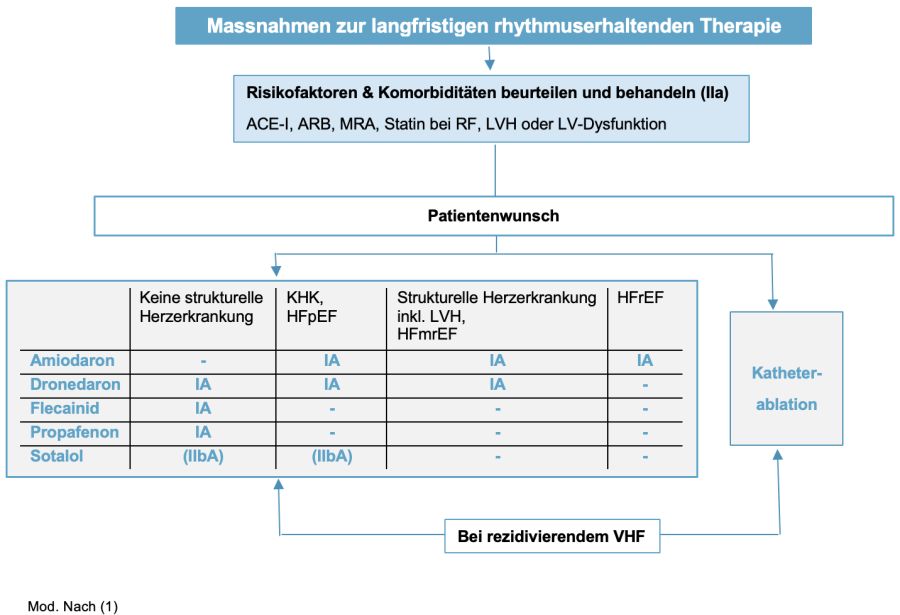
- Die Wahl des AAD erfolgt unter Berücksichtigung kardialer Begleiterkrankungen, Potenzial für Proarrhythmie und extrakardial toxischen Effekten, Patientenpräferenz und Symptombelastung (31)
- Flecainid (100–200 mg 2 x/d) oder Propafenon (150–300 mg 3 x/d) sollten nur bei normaler LVEF und ohne strukturelle Herzerkrankung (inklusiv signifikanter LVH und Myokardischämie) eingesetzt werden (IA)
- Amiodaron ist das Medikament mit der höchsten Effektivität zur Prophylaxe von VHF-Rezidiven und kann bei allen Patienten mit VHF eingesetzt werden, auch bei struktureller Herzerkrankung, akuter Herzinsuffizienz und HFrEF (IA). Wegen seiner extrakardialen Toxizität sollte aber wenn möglich anderen AAD in der Langzeittherapie der Vorzug gegeben werden
Dosierung: Nach Auftitrationsphase mit 600 (–800–1‘000) mg tgl. über 8–10 d –> Erhaltungsdosis von 100–400 mg/d - Dronedaron (400 mg 2 x/d) hat ein besseres Sicherheitsprofil als Amiodaron, jedoch auch eine niedrigere Effektivität (32, 33). Es wird zum langfristigen Rhythmus-Erhalt empfohlen bei erhaltener oder allenfalls leicht reduzierter (stabiler) LV-Funktion und kann auch bei struktureller oder ischämischer Herzerkrankung angewandt werden (IA). Sollte nicht angewendet werden bei NYHA Klasse III–IV, in Kombination mit QT-verlängernden Medikamenten oder starken CYP3A4-Inhibitoren (z. B. Verapamil, Diltiazem) und wenn CrCl < 30 ml/min beträgt. Die gleichzeitige Anwendung mit Dabigatran ist kontraindiziert
- Sotalol (80–160 mg 2 x/d) wurde wegen seines hohen Risikos für Proarrhythmien als Empfehlung herabgestuft. Es kann zum Rhythmus-Erhalt bei normaler LVEF oder ischämischer Herzerkrankung erwogen werden (IIbA), wenn eine engmaschige Überwachung des QT-Intervalls, Kaliumspiegels, Kreatinin-Clearance und anderer Risikofaktoren für Proarrhythmien gewährleistet ist. Sollte nicht angewendet werden bei Patienten mit: HFrEF, signifikanter LVH, verlängerter QT, Asthma, Hypokaliämie, CrCl < 30 ml/min
- EKG-Kontrollen werden zu Beginn der Therapie sowie nach 1–2 Wochen (Flecainid/Propafenon) bzw. 4 Wochen (Amiodaron/Dronedaron) empfohlen. Warnzeichen für drohende Proarrhythmie sind (34)
- Abnorme Verlängerung der QRS-Dauer um > 25 % des Ausgangswerts
- Abnorme Verlängerung der QT-Zeit um > 60 ms (oberer Grenzwert frequenzkorrigierte QT-Zeit [QTc] 440 ms; ab 500 ms ist von einem hohen Risiko auszugehen)
- Eine AAD-Therapie wird nicht empfohlen bei verlängertem QTc-Intervall > 0,5 s oder relevanter Sinus- oder AV-Knoten-Funktionsstörung (IIIC). Ausnahme: Bei Amiodaron, das ein im Vergleich der AAD geringes proarrhythmisches Potential besitzt, kann im Einzelfall unter Verlaufskontrollen auch eine QT-Verlängerung > 0,5 s toleriert werden.
4.2.4. Katheterablation
- Indikation
- Rhythmuskontrolle nach erfolgloser medikamentöser Therapie oder Unverträglichkeit von Klasse-I/III-Antiarrhythmika (IA)
- First-line-Therapie zur Verbesserung der LV-Funktion, wenn mit hoher Wahrscheinlichkeit eine Tachykardie-induzierte Kardiomyopathie besteht, unabhängig vom Symptomstatus (IB) – bei Patienten mit schwerer Herzinsuffizienz und reduzierter LVEF, um das Überleben zu verbessern und die Hospitalisierungen zu reduzieren (IIaB).
- Als Erstlinientherapie nur bei ausgewählten Patienten zu erwägen (Klasse II-Empfehlung) mit symptomatischem paroxysmalem VHF (IIaB) oder persistierendem VHF ohne grössere Risikofaktoren für Rezidive (IIbC). Ziel des Eingriffs ist die vollständige elektrische Isolierung der Lungenvenen als Triggerfoci für VHF (IA)
- Erfolgsraten: Die Ablation ist der medikamentösen Kardioversion betreffend Rezidivprophylaxe von VHF überlegen. Die Erfolgsraten beim paroxysmalen VHF liegen um 80 % nach im Mittel 1,5 Prozeduren pro Patient (Es ist nicht selten mehr als ein Eingriff nötig). Beim persistierenden VHF ist die Erfolgsrate wesentlich geringer wegen häufig extrapulmonalvenösen Triggern. Hier kommt es bei ca. 30 % der Patienten trotz Mehrfacheingriffen zu Rezidiven (28–29)
- Prädiktoren für reduzierte Erfolgschancen für Rezidive nach Ablation sind ein deutlich dilatierter linker Vorhof als Indikator für ein bereits ausgeprägtes atriales Remodelling, eine lange Dauer des VHF, relevante strukturelle Herzerkrankungen und hohe Frequenzen der Vorhoferregung. Für Patienten mit Herzinsuffizienz ist die Eliminierung der Arrhythmie langfristig schwierig zur erreichen, falls erfolgreich kann dies jedoch das Überleben verbessern und die Hospitalisierungen reduzieren (IIaB)
- Komplikationen (28): Durch neuere, verbesserte Ablationstechniken sind Komplikationen mittlerweile deutlich seltener geworden. Wenn dann treten sie in der Regel früh periprozedural auf
- Periprozeduraler Tod < 0,2 %
- Herztamponade 1–2 %
- Ösophagus-Verletzung (Perforation/Fistel) < 0,5 % (Hinweis auf Ösophagusfistel: Patienten, die sich in ersten Wochen nach einer Ablation mit der Triade von unspezifischen Infektionszeichen, Brustschmerz und Schlaganfall oder TIA vorstellen –> erfordert sofortige Behandlung!)
- Periprozeduraler Schlaganfall/TIA < 1 %
- Pulmonalvenenstenose < 1 %
- Anhaltende Phrenikusparese 1–2 %
- Gefässkomplikationen (AV-Fistel, Aneurysma spurium) 2–4 %.
- Antikoagulation
- Präprozedural wird bei VHF mit Schlaganfall-Risikofaktoren die Einleitung und therapeutische OAK über mind. 3 Wochen empfohlen (IC), alternativ sollte eine TEE zum Ausschluss eines LA-Thrombus erwogen werden (IIaC)
- Bei Patienten, die bereits therapeutisch antikoaguliert sind, soll die Ablation ohne OAK-Unterbrechung durchgeführt werden (IA)
- Nach Ablation wird für alle Patienten empfohlen, die OAK für mind. 2 Monate fortzusetzen, darauf folgt die Entscheidung über eine langfristige Fortsetzung basierend auf dem Schlaganfall-Risiko im CHA2DS2-VASc-Score unabhängig vom Ablationserfolg (IC), aufgrund möglicher asymptomatischer Rezidive
- Nachsorge (1, 30)
- Nach Ablation sollten die Patienten nach 3 Monaten und danach jährlich untersucht werden
- Die klinische Praxis hinsichtlich der Antiarrythmika-Behandlung nach Ablation variiert. Es gibt keine überzeugenden Beweise, dass eine solche Behandlung routinemässig erforderlich ist, aber Hinweise, dass die Fortsetzung der Antiarrhythmika (AAD)-Behandlung für 6 Wochen bis 3 Monate frühe VHF-Rezidive, Rehospitalisierungen und Kardioversionen in diesem Zeitraum verringern kann
- Rezidive jenseits des 1. Monats nach der Ablation sind prädiktiv für späte Rezidive.
4.3. „C“ – Kardiovaskuläre Risikofaktoren und Begleiterkrankungen erkennen und behandeln
Die Identifizierung und Behandlung von Risikofaktoren und Begleiterkrankungen wird als integraler Bestandteil des Managements von VHF empfohlen (IB), als Strategien zur Verringerung der VHF-Last und Symptome sowie zum SR-Erhalt nach Rhythmisierung. Dies umfasst
- Gute Blutdruckeinstellung (IB), um VHF-Rezidive und das Risiko für Schlaganfall und Blutungen zu reduzieren
- Modifikation eines ungesunden Lebensstils (IB)
- Gewichtsreduktion bei adipösen Patienten (Ziel BMI < 27 kg/m2, IIaB), v. a. wenn eine Ablation durchgeführt werden soll (IB)
- Regelmässige körperliche Aktivität (IIaC), ausgenommen hiervon sind exzessive Ausdauerübungen, die das Auftreten von VHF fördern können
- Verringerung des Alkoholkonsums (IIaB)
- Optimales Management einer OSA (IIbC).
4.4. Vorhofflattern
Die ABC-Wegleitung gilt auch für Patienten mit Vorhofflattern (VHFla).
- Für die Schlaganfallprävention/Antikoagulation sollen die gleichen Strategien wie bei VHF angewendet werden (35)
- Erste Massnahme beim Symptom-Management ist die Rhythmus-Kontrolle. Allerdings ist diese im Vergleich zum VHF beim VHFla schwieriger zu erreichen. Grund: Während AV-blockierende Medikamente beim VHF die mittlere HF senken, ist die AV-Überleitung beim VHFla häufig 2 : 1 fixiert
- Die Kardioversion, insbesondere die elektrische Kardioversion, ist daher als Tool zur Symptomkontrolle häufig effizienter (36). Medikamentös können Klasse III-Antiarrythmika (AAD) wie Amiodaron das VHFla wirksam unterbrechen, während Klasse IC-AAD wie Flecainid und Propafenon allenfalls unter dem Schutz zusätzlicher AV-blockierender Substanzen (wie Betablocker, Kalziumantagonisten/NDCCB, Digoxin) eingesetzt werden können (37). Grund: IC-AAD verlangsamen die Vorhoffrequenz und können damit eine
1 : 1-AV-Überleitung mit hoher Kammerfrequenz begünstigen - Die Katheterablation ist die wirksamste Therapie beim VHFla (38), v. a. für typisches isthmusabhängiges VHFla (Erfolgsrate 92–97 %, Rezidivrate 8–10 %).
5. Literatur
- Hindricks G, et al.: ESC Scientific Document Group (2021) 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 42(5):373–498. https://doi.org/10. 1093/eurheartj/ehaa612.
- Potpara TS, Lip GYH, Blomstrom-Lundqvist C, BorianiG, VanGelder IC,Heidbuche lH,Hindricks G, Camm AJ (2021): The 4S-AF Scheme (Stroke Risk; Symptoms; Severity of Burden; Substrate): A Novel Approach to In-Depth Characterization (Rather than Classification) of Atrial Fibrillation. ThrombHaemost121(3):270–278.https://doi.org/ 10.1055/s-0040-1716408.
- Lip GYH (2017): The ABC pathway: an integrated approach to improve AF management. Nat Rev Cardiol 14(11):627–628. https://doi.org/10.1038/nrcardio.2017.153.
- Pan KL, Wu YL, Lee M, Ovbiagele B (2021): Catheter ablation compared with medical therapy for atrial fibrillation with heart failure: a systematic review and meta-analysis of randomized controlled trials. Int J Med Sci 18(6):1325–1331. https://doi.org/10. 7150/ijms.52257.
- Marrouche NF, Brachmann J, Andresen D, Siebels J, Boersma L, Jordaens L, et al. (2018): Catheterablation for atrial fibrillationwith heartfailure. N Engl J Med 378:417–427.
- Staerk L, Wang B, Preis SR, Larson MG, Lubitz SA, Ellinor PT, et al. (2018): Lifetime risk of atrial fibrillation according to optimal, borderline, or elevated levels of risk factors: cohort study based on longitudinal data from the Framingham Heart Study. BMJ 361:k1453.
- Wynn GJ, Todd DM, Webber M, et al. (2014): The European heart rhythm association symptom classification for atrial fibrillation: validation and improvement through a simple modification. Europace16(7):965 972.https://doi.org/10.1093/ europace/eut395.
- Yan-Guang Li, Arnaud Bisson, Alexandre Bodin, Julien Herbert, Leslie Grammatico-Guillon, Boyoung Joung, Yu-Tang Wang, Gregory Y. H. Lip, Laurent Fauchier (2019): C2 HEST Score and Prediction of Incident Atrial Fibrillation in Poststroke Patients: A French Nationwide Study. 10.1161/JAHA.119.012546.
- Lopez Perales CR, Van Spall HGC, Maeda S, Jimenez A, Laţcu DG, Milman A, KirakoyaSamadoulougou F, Mamas MA, Muser D, Casado Arroyo R (2021): Mobile health applications for the detection of atrial fibrillation: a systematic review. Europace 23(1):11–28. https://doi.org/10.1093/ europace/euaa139.
- Perez MV, Mahaffey KW, Hedlin H, Rumsfeld JS, Garcia A, Ferris T, Balasubramanian V, Russo AM, Rajmane A, Cheung L, Hung G, Lee J, Kowey P, Talati N, Nag D, Gummidipundi SE, Beatty A, Hills MT, Desai S, Granger CB, Desai M, Turakhia MP, Apple Heart Study Investigators (2019): Largescale assessment of a Smartwatch to identify atrial fibrillation. N Engl J Med 381(20):1909–1917. https://doi.org/10.1056/NEJMoa1901183.
- Hart RG, Benavente O, McBride R, Pearce LA: Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann Intern Med. 1999;131(7):492-501.
- Ruff CT, et al.: Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014; 383: 955–962.
- F. Gage, A.D. Waterman, W. Shannon, M. Boechler, M.W. Rich, M.J. Radford: Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. In: JAMA. 285, Nr. 22, 2001, S. 2864–70. doi:10.1001/jama.285.22.2864.
- Lowres N, Mulcahy G, Jin K, Gallagher R, Neubeck L, Freedman B: Incidence of postoperative atrial fibrillation recurrence in patients discharged in sinus rhythm after cardiac surgery: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg 2018;26:504–511.
- Konstantino Y, Zelnik Yovel D, Friger MD, Sahar G, Knyazer B, Amit G.: Postoperative atrial fibrillation following coronary artery bypass graft surgery predicts long-term atrial fibrillation and stroke. Isr Med Assoc J 2016;18:744–748.
- AlTurki A, Marafi M, Proietti R, Cardinale D, Blackwell R, Dorian P, Bessissow A, Vieira L, Greiss I, Essebag V Healey JS, Huynh T: Major adverse cardiovascular events associated with postoperative atrial fibrillation after noncardiac surgery: a systematic review and meta-analysis. Circ Arrhythm Electrophysiol 2020;13:e007437.
- Van Geldern IC, et al.: Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT, Eur Heart J 2017, online 1. März, DOI: https://doi.org/10.1093/eurheartj/ehx042.
- Pisters R, Lane DA, Nieuwlaat R, et al.: A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138: 1093-1100.
- Reddy VY, Sievert H, Halperin J, et al. (2014): Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial. JAMA 312:1988–1998.
- Holmes DR, Kar S, Price MJ, et al. (2014): Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J Am Coll Cardiol 64:1–12.
- Tzikas A, Gafoor S, Meerkin D, Freixa X, Cruz-Gonzalez I, Lewalter T, et al.: Left atrial appendage occlusion with the AMPLATZER Amulet device: an expert consensus step-by-step approach. EuroIntervention. 2016;11(13):1512-21.
- Boersma LV, Ince H, Kische S, Pokushalov E, Schmitz T, Schmidt B, et al.: Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation: 1-Year follow-up outcome data of the EWOLUTION trial. Heart Rhythm. 2017;14(9):1302-8.
- Wyse DG, Waldo AL, DiMarco JP, Domanski MJ, Rosenberg Y, Schron EB, et al. (2002): Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation.N Engl JMed347:1825–1833.
- Van Gelder IC, Hagens VE, Bosker HA, Kingma JH, Kamp O, Kingma T, et al. (2002): Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 347:1834–1840.
- Van Gelder IC, Groenveld HF, Crijns HJGM, Tuininga YS, Tijssen JGP, Alings AM, et al. (2010): Lenient versus strict rate control in patients with atrial fibrillation.N Engl J Med 362:1363–1373.
- Kirchhof P, et al. EAST-AFNET 4 Trial Investigators (2020) Early rhythm-control therapy in patients with atrial fibrillation. N Engl J Med383(14):1305–1316.https://doi.org/10.1056/ NEJMoa2019422
- Crijns HJGM, Weijs B, Fairley AM, et al.: Contemporary real life cardioversion of atrial fibrillation: Results from the multinational RHYTHM-AF study. Int J Cardiol 2014; 172: 588–94.
- Cappato R, Calkins H, Chen SA, et al. (2009): Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 3(1):32–38.
- Ouyang F, Tilz R, Chun J,et al. (2010): Long-term results of catheter ablation in paroxysmal atrial fibrillation: lessons from a 5-year follow-up. Circulation 122(23):2368–2377.
- Calkins H, Hindricks G, Cappato R, et al. (2018) 2017: HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: executive summary. Europace 20(1):157- 208. https://doi.org/10.1093/europace/eux.
- Freemantle N, Lafuente-Lafuente C, Mitchell S, Eckert L, Reynolds M (2011): Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation. Europace 13:329–345.
- Piccini JP, Hasselblad V, Peterson ED, Washam JB, Califf RM, Kong DF (2009): Comparative efficacy of dronedarone and amiodarone for themaintenance of sinus rhythm in patients with atrial fibrillation. J Am Coll Cardiol 54:1089–1095.
- Gao S, Dai W, Zhang L, Juhaeri J, Wang Y, Caubel P (2013): Risk of cardiovascular events, stroke, congestive heart failure, interstitial lung disease, and acute liver injury: dronedarone versus amiodarone and other Antiarrhythmics. J Atr Fibrillation6:890.
- Fabritz L, Kirchhof P (2010): Predictable and less predictable unwanted cardiac drugs effects: individual pre-disposition and transient precipitating factors. Basic Clin Pharmacol Toxicol 106:263–268.
- Vadmann H, Nielsen PB, Hjortshoj SP, Riahi S, Rasmussen LH, Lip GY, Larsen TB: Atrial flutter and thromboembolic risk: a systematic review. Heart 2015;101:1446-455.
- Van Gelder IC, Crijns HJ, Van Gilst WH, Verwer R, Lie KI: Prediction of uneventful cardioversion and maintenance of sinus rhythm from direct-current electrical cardioversion of chronic atrial fibrillation and flutter. Am J Cardiol 1991;68:41-46.
- Crijns HJ, Van Gelder IC, Kingma JH, Dunselman PH, Gosselink AT, Lie KI: Atrial flutter can be terminated by a class III antiarrhythmic drug but not by a class IC drug. Eur Heart J 1994;15:1403-1408.
- Natale A, Newby KH, Pisano E, Leonelli F, Fanelli R, Potenza D, Beheiry S, Tomassoni G: Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol 2000;35:1898-1904.
- Svennberg E, et al.: Clinical outcomes in systematic screening for atrial fibrillation (STROKESTOP): a multicentre, parallel group, unmasked, randomised controlled trial. Lancet 2021; 398:1498.
- Svendsen JH, et al.: Implantable loop recorder detection of atrial fibrillation to prevent stroke (The LOOP Study): a randomised controlled trial. Lancet. 2021 Oct 23;398(10310):1507-1516. doi: 10.1016/S0140-6736(21)01698-6. Epub 2021 Aug 29. Erratum in: Lancet. 2021 Oct 23;398(10310):1486. PMID: 34469766.
6. Anhang
Tabelle: Evidenzkategorien gemäss ESC/EAS Guidelines (1)

7. Impressum
Diese Guideline wurde im März 2022 aktualisiert.
© Verein mediX schweiz
Herausgeberin
PD Dr. med. Corinne Chmiel
Redaktion
Dr. med. Uwe Beise
Dr. med. Felix Huber
Dr. med. Maria Huber
Autorin
Dr. med. Andrea Rosemann
Rückmeldungen bitte an:
Diese Guideline wurde ohne externe Einflussnahme erstellt. Es bestehen keine finanziellen oder inhaltlichen Abhängigkeiten gegenüber der Industrie oder anderen Einrichtungen oder Interessengruppen.
mediX Guidelines enthalten therapeutische Handlungsempfehlungen für bestimmte Beschwerdebilder oder Behandlungssituationen. Jeder Patient muss jedoch nach seinen individuellen Gegebenheiten behandelt werden.
mediX Guidelines werden mit grosser Sorgfalt entwickelt und geprüft, dennoch kann der Verein mediX schweiz für die Richtigkeit – insbesondere von Dosierungsangaben – keine Gewähr übernehmen.
Der Verein mediX schweiz ist ein Zusammenschluss von Ärztenetzen und Ärzten in der Schweiz.
Verein mediX schweiz, Sumatrastr. 10, 8006 Zürich.
