Guideline
Chirurgie in der Hausarztmedizin
Zuletzt revidiert: 09/2020 Letzte Änderung: 05/2023
Aktualisierung 05/2023
- Das Kapitel 2 (Behandlung chronischer Wunden) wurde überarbeitet.
Aktualisierung 09/2020
- Das Kapitel Traumatologie wurde um den Abschnitt Skidaumen (Kapitel 3.4.) ergänzt
- Das Kapitel 5.3. wurde um Gallenblasenpolypen erweitert.
Vorbemerkungen
Das chirurgische Grundwissen in der Hausarztpraxis ist durch den Wegfall des obligaten Chirurgiejahres in der Weiterbildung zum Facharzt/zur Fachärztin für AIM oft ungenügend. Aber auch erfahrene HausärztInnen sind nicht in allen Chirurgiebereichen gleich sattelfest. Zudem gibt es in der Wund- und Frakturbehandlung immer wieder Änderungen mit teilweise auch zu kostspieligen Empfehlungen. mediX möchte auch in der Chirurgie für die Hausarztpraxis einen Beitrag für eine möglichst hohe Kompetenz der Grundversorger und eine kosteneffiziente und qualitativ hochstehende Betreuung der Patienten leisten.
1. Wundversorgung in der Hausarztpraxis
Wichtige Fragen nach
- Verletzungsmechanismus
- Alter der Verletzung
- Fremdkörper in der Wunde
- Grösse und Tiefe der Wunde
- Verletzung benachbarter Strukturen (Sehnen, Nerven)
- Immunstatus Tetanus (–> Auffrischimpfung 10 Jahre nach letzter Impfung; bei letzter Impfung zwischen 25–65 J.: 20 Jahre)
- Einfache Wunden können problemlos in der Hausarztpraxis versorgt werden. Eine saubere, nicht infizierte Wunde kann sogar bis zu 18 h nach Verletzung primär verschlossen werden, im Gesicht sogar bis zu 24 h nach Verletzung
- Nach einer Wundreinigung und allenfalls Fremdkörperentfernung folgt die Primärnaht vorzugsweise mit Ethilon (Nylon); im Gesicht 5-0, an den Extremitäten 4-0 oder 3-0, am Rücken 2-0
- Bei Verletzungen am behaarten Haupt ist eine Rasur nicht notwendig
- Falls eine Subkutannaht nötig ist, wird diese vorzugsweise mit Vicryl (resorbierbar) durchgeführt
- Die Wunden können trocken verbunden werden und bedürfen in der Regel keiner regelmässigen Kontrollen vor der Fadenentfernung. Duschen und Kontakt mit Wasser und milden Seifen ist im Prinzip ab sofort erlaubt, längeres Baden insbesondere in chlorhaltigem Wasser sollte vermieden werden.
Antibiotikaprophylaxe
- In der Regel nicht notwendig. Nur bei stark verschmutzten Wunden, Menschen- und Tierbissen, sowie Schnittverletzungen mit Messern, welche vorher in Kontakt mit rohem Fleisch waren, muss eine Antibiotikaprophylaxe erfolgen, allerdings sollte hierbei kein Primärverschluss durchgeführt werden. Tier- und Menschenbisse müssen zusätzlich exzidiert, nachfolgend ruhiggestellt und regelmässig kontrolliert werden
- Im Zweifelsfall Wunden offenlassen und per secundam heilen lassen. Ausnahme: Verletzungen im Gesicht.
Fadenentfernung
- Gesicht: 5 Tage
- Behaartes Haupt: 7–14 Tage
- Rumpf und obere Extremität: 7–10 Tage
- Untere Extremität: 10–14 Tage
- Über Gelenken: 14 Tage.
Wundversorgung bei Kindern
- Handelt es sich um kleine, saubere Wunden (< 5 cm) und sind die Wundränder spannungsfrei, kann ein Wundverschluss mit Hautkleber (z. B. Dermabond®) vorgenommen werden. Diese Art des Wundverschlusses eignet sich typischerweise an der Stirn, nicht dagegen am behaarten Haupt.
Cave: Der Leim trocknet sehr schnell!
1.1. Okklusivverband (1)
- Bei Fingerkuppenverletzungen/Teilamputationen der Fingerbeere zeigt sich unter einer okklusiven Therapie eine ausgezeichnete Wundheilung
- Als relative Kontraindikation gelten Verletzungen mit Fleischmessern. Eine absolute Kontraindikation für den Okklusivverband ist eine Gelenk- und/oder Sehnenbeteiligung sowie ein Nichttolerieren des Okklusivverbandes
- Eine Alternative für den Okklusivverband ist die lokale Lappendeckung.
Vorgehen
Wundexploration
- Der Wundgrund muss gereinigt und von Fremdkörpern befreit werden
- Eine aktive Blutung muss in einer Leitungsanästhesie vor Anlage des Okklusivverbandes gestoppt werden (am besten mit Elektrokoagulation)
- Ein frei liegender Knochen ist prinzipiell keine Kontraindikation für eine Okklusivtherapie. Dafür sollte das Knochenende mit dem Luer gekürzt werden
- Die intakte Haut am Finger muss mit Wundbenzin entfettet werden. Danach kann die Folie (z. B. Bioclusive® Plus, Opsite® Visible etc.) aufgebracht werden, wobei an der Spitze ein Reservoir in der Grösse des Defektes belassen werden soll. Nachdem der Verband dicht angebracht wurde, kann eine Ruhigstellung für 2–3 Wochen mittels Schiene erfolgen. Eine Antibiotikaprophylaxe ist nicht notwendig
- Nach Möglichkeit sollte der Okklusivverband für insgesamt drei Wochen belassen werden. Eine erste Dichtigkeitskontrolle findet nach 1–2 Tagen statt, anschliessend einmal wöchentlich, wobei der Verband bei Bedarf nur „nachgebessert“ und nicht abgenommen werden sollte
- Nach drei Wochen Abnahme des Verbandes und Abspülen des Fingers unter warmem Wasser. Anschliessend Verband mit Ialugen® Salbe oder anderer hautpflegender Fettsalbe
- Kontrolle 2 Tage später bzw. je nach Bedarf.
Cave: Eine gute Patientenaufklärung ist notwendig, da der Verband teilweise sehr unangenehm riechen kann! - Siehe auch: Hoigné: Der Folienverband 04/2015.
1.2. Verbrennungen
Ursache
- Meist durch Feuer und Verbrühungen verursacht.
Anamnese
- Wie hat sich der Unfall ereignet?
- Wo hat der Unfall stattgefunden?
- Warum ist es zur Verbrennung gekommen?
- Wie alt/krank ist der Patient (Immunschwäche, Diabetes etc.)?
Einteilung
Grad I
- Oberflächliche Verbrennung, Erythem, Rötung, keine Narbenbildung.
Grad II
- IIa: Oberflächliche dermale Verbrennung mit Blasenbildung unter der Epidermis, Rötung wegdrückbar, feuchter Wundgrund, schmerzhaft auf Berührung, keine Narbenbildung
- IIb: Tiefe dermale Verbrennung, Schädigung bis ins Korium, Rötung nicht wegdrückbar, trockener Wundgrund, Narbenbildung.
Grad III
- Zerstörung der ganzen Haut und der Anhangsgebilde. Nekrosen, Schorfbildung, keine Schmerzempfindlichkeit, Narbenbildung häufig mit Kontrakturen und Keloid.
Grad IV
- Verkohlung des Gewebes.
Ausdehnung der Verbrennung
Handflächenregel: Handfläche des Patienten = 1 % Körperoberfläche.
Ab > 10 % Verbrennung Grad I–IIa Überweisung ins Spital.
Therapie
Allgemein
- Rasche Kühlung (ca. 20 °C kühles Wasser). Cave: Kühlung mit Eis –> Hautschädigung durch Erfrierungen
- Für die Desinfektion kein farbiges Desinfektionsmittel verwenden (kein Betadine®). Tetanusprophylaxe ggfls. auffrischen
- Keine prophylaktische Antibiotikagabe!
Grad I
- Rückfettende Salbe (beispielsweise Ialugen® Salbe, Bepanthen® Salbe etc.), Analgesie.
Grad IIa
- Reinigung mit Octenisept®, Wundverband beispielsweise mit Ialugen Plus® Salbe oder Flammazine® dick aufgetragen, steril abdecken, locker einbinden, ggfls. Ruhigstellung, Analgesie
- Kontrolle nach 2–4 Tagen. Im weiteren Verlauf ggfls. Wechsel auf Ialugen® Gaze oder Atrauman®. Verbände nach dem ersten Verbandwechsel täglich erneuern. Intakte Blasen primär belassen. Bei Verbrennungen im Gesicht und Hals/Decolleté kortisonhaltige Salbe 2–3 x/d auftragen, damit ein trockener Schorf entstehen kann. Wichtig ist zudem während des Heilungsprozesses ein konsequenter Sonnenschutz, um eine Pigmentverschiebung zu vermeiden.
Grad IIb–IV
- Überweisung ins Spital zur weiteren Therapie (Exzision und Deckung z. B. mit Spalthaut).
2. Behandlung chronischer Wunden (1–6)
Grundsatz: Weniger ist häufig mehr.
Ein häufiges Wechseln der Verbandsstrategie sollte wenn möglich verhindert werden. Die Wunden heilen nicht schneller, die Kosten und der Aufwand sind jedoch erheblich. Je nach Wundgrösse muss man den Patienten unmittelbar darüber aufklären, dass eine Wundheilung Wochen bis Monate (zum Beispiel Sinus Pilonidalis) andauern kann.
Ein VAC-Verband kann bei tiefen Wunden sowie bei stark sezernierenden Wunden eine gute Alternative darstellen. Jedoch ist die Akzeptanz von Seiten der Patienten häufig nicht da und das Handling in der Praxis setzt eine gewisse Erfahrung voraus.
⇒ Details zu Wundmaterialien s. mediX FS Wundversorgung (Login MPP)
Eine Wundbehandlung beinhaltet die folgenden Schritte
- Wundbeurteilung, -dokumentation
- Wundreinigung
- Débridement
- Primäre und sekundäre Wundauflage.
2.1. Wundbeurteilung
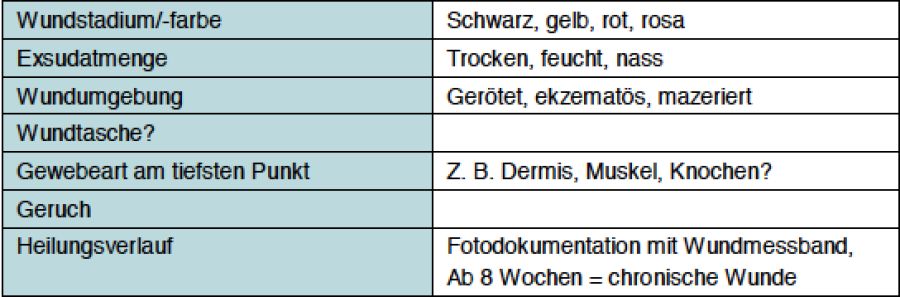
2.2. Wundreinigung
Reizlose Wunden
- Mit NaCl 0,9 % oder Ringerlösung reinigen (angefangene Flasche max. 1 Tag benutzen).
Infektiöse Wunden
Desinfektion mit Antiseptikum
- Keine jodhaltigen Lösungen verwenden (potentiell zytotoxisch)
- Bei Verschwinden der klinischen Infektionszeichen wieder auf NaCl/Ringerlösung umstellen.
Belegte Wunden
Nass-/Trockenphase
- Sterile Kompressen mit NaCl 0,9 % oder Ringerlösung gut benetzen und ca. 10 min auf der Wunde belassen. Anschliessend sterile trockene Kompresse während ca. 10 min auf die Wunde legen. Dadurch werden Beläge schonend entfernt, ohne das neue Granulationsgewebe zu beschädigen
- Bei infektiösen Wunden wird die Nass-/Trockenphase mit einem Aseptikum (z. B. Prontosan® oder Octenisept®) durchgeführt.
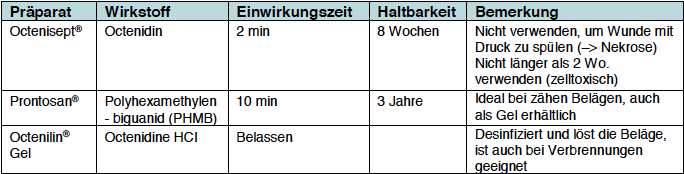
2.3. Débridement
Ein Débridement sollte möglichst sanft durchgeführt werden, um bereits granuliertes Gewebe nicht zu beschädigen.
Leichte Beläge
- Nass-/Trockenphase (vgl. Wundreinigung). Falls die Beläge sehr trocken sind, die Wunde bis zum nächsten Verbandwechsel mit Gel feucht halten.
Zähe Beläge
- Nach Nass-/Trockenphase mit Rundtupfer entfernen.
Zähe Beläge, die sich mit Rundtupfer nicht entfernen lassen
Mechanisches Débridement
- Kompresse mit Lidocain 1 % tränken, 15–20 min auf Wunde legen (Wirkungsdauer: 20–40 min)
- Débridement mit Curette oder Schere/Skalpell
- Desinfektion mit nicht jodhaltigen Desinfektionsmitteln (siehe Tabelle in Kap. 2.2.)
- Bei PAVK nur zurückhaltend debridieren (1).
2.4. Wundumgebung und Verbandwechsel
Wundrand und -umgebung müssen ev. geschützt werden mit
- Zinkcrème
- Bei mazerierter Haut: Hydrofaser, welche über den Wundrand hinausreicht (s. mediX FS Wundversorgung)
- Ev. mit Hydrokolloid abdecken.
Der Verband sollte so wenig wie möglich gewechselt werden, um neues Granulationsgewebe nicht zu zerstören. Das Intervall richtet sich nach dem Verbandmaterial und dem Heilungsverlauf. Stark exsudierende oder infektiöse Wunden müssen jedoch 1–2 x tgl. neu verbunden werden.
2.5. Wundinfektion
Symptome
- Verzögerte oder stagnierende Wundheilung
- Geruchsbildung
- Erhöhte Exsudation.
Diagnostik
- Infektionszeichen (Calor, Dolor, Rubor, Tumor, Functio laesa)
- Leukozytose
- Erhöhtes CRP.
Wundabstriche
Nicht bei jeder Wunde sollte ein Abstrich vorgenommen werden, da sich immer Keime in einer Wunde befinden. Dieser sollte gemacht werden
- Bei chronischen Wunden, die keinerlei Heilung zeigen und putride sezernieren
- Zum Ausschluss MRSA-Besiedlung
- Vor Beginn einer systemischen Antibiotikatherapie (zum Beispiel bei tiefen Wunden und Vd. a. Osteomyelitis)
- Bei atypischen Wunden (kein adäquates Trauma, junge Patienten, auffällige Lokalisation).
Behandlung
- Wunde mit Antiseptikum behandeln
- Eine systemische Behandlung mit Antibiotikum ist nur bei klinischen Infektionszeichen indiziert (3, 4), vor Beginn sollte ein Abstrich aus der Wunde entnommen werden (s. o.). Eine Hospitalisation muss in Betracht gezogen werden bei Anzeichen einer Sepsis/SIRS
- Schmerzen: Analgetikagabe 30–60 min vor Verbandwechsel
- Bei Schmerzen im Wundbett: Nassphase mit Lidocain 1 %.
2.6. Sonderformen chronischer Wunden und deren Therapie
Differentialdiagnosen bei schlecht heilenden Wunden
- PAVK ausschliessen bzw. behandeln
- Venöse insuffizienz behandeln
- Dekubitus?
- Maligne? –> Stanzbiopsie zur histologischen Beurteilung
- Frakturen die nicht diagnostiziert wurden?
- Wundinfekt/Osteomyelitis?
Ulcus cruris
- Ist meist venös bedingt, seltener arteriell, relativ häufig Mischformen: 48,25 % venös, 11,8 % gemischt, 14,8 % arteriell (5). Seltenere Ursachen sind diabetische Neuropathie, physische Verletzungen (Druck, thermische Schädigung, Bestrahlung, iatrogen, faktitiell, nicht erkannte Fraktur), Infektionen, Pyoderma gangraenosum, Vaskulitis etc.
Venöses Ulkus
- Kompression unerlässlich mit Tubegaze, Polsterwatte, Kurzzugbinden (Spitex anmelden)
–> Wichtig: Vor Beginn der Kompressionstherapie Fusspulse prüfen (ggfls. mit Doppler)! - Bei einer Stauungsdermatitis kann eine kurzzeitige Therapie mit Elocom® Salbe angewendet werden. Die Haut sollte danach jedoch gut gepflegt werden (z. B. mit Excipial®).
Arterielles Ulkus
- Eher wenig Exsudat, sieht meist aus wie ausgestanzt. Möglichst keine Kompression.
Dekubitus
- Begleitbehandlung durch Druckentlastung (z. B. Freilagerung der betroffenen Stellen, Wechseldruckmatratze, Gel-Kissen)
- Ab Dekubitus Grad III (vollständiger Gewebeverlust) muss eine Niederdrucktherapie oder Lappenplastik in Betracht gezogen werden
- Weitere Informationen: Leitlinie: Behandlung und Prävention von Dekubitus 2019.
Diabetisches Fusssyndrom
- Osteomyelitis ausschliessen (im konventionellen Röntgen „Mottenfrass“, besser im MRI beurteilbar.) Allerdings muss man mit dem Patienten vor einer entsprechenden Diagnostik die möglichen Konsequenzen diskutieren. Lehnt der Patient generell eine operative Therapie ab, muss die Indikation für eine Bildgebung eng gestellt werden und stattdessen pragmatisch auf der Basis einer Bakteriologie eine Langzeit-Antibiotikatherapie diskutieren
- Orthopädische Schuhversorgung bei diabetischem Fuss-Ulkus (Einlage, Massschuhe).
Hautablederung
- Die Haut wenn möglich über die Wunde ziehen (wächst meistens wieder an).
Wundbehandlung beim alten Menschen
- Stark klebende Wundauflagen oder Fixierungen sorgfältig lösen. Das gelingt sehr gut, wenn diese zuvor mit NaCl 0,9 % oder Ringerlactat befeuchtet werden
- Hautschutzspray oder -Cremes verwenden (z. B. Cavillon®)
- Bei Pergamenthaut eher mit elastischer Gazebinde fixieren statt ankleben.
3. Traumatologie
3.1. Radiusfraktur (9–12)
- Häufigste Fraktur der oberen Extremität, in der Regel durch einen Sturz auf die ausgestreckte Hand mit dem Handgelenk in Extensionsstellung
- Gehäuft in 2 Gruppen
- Bei jungen Patienten im Rahmen von Sportverletzungen
- Ältere Patienten (Frauen häufiger als Männer) mit osteoporotisch veränderten Knochen.
Diagnostik
Anamnese
- Sturzmechanismus, vorausgegangene Traumata oder Erkrankungen (Karpaltunnelsyndrom) im Handgelenkbereich. Ebenfalls wichtig zu wissen ist, ob es sich um eine Verletzung der dominanten oder adominanten Hand handelt.
Klinik
- Schwellung und gelegentlich eine deutliche Fehlstellung über dem Handgelenk, selten Anzeichen für eine offene Fraktur. Das Fehlen der klassischen Fourchette-Stellung (Dislokation nach dorsal: Vor allem von der Seite betrachtet besteht eine Gabel-ähnliche Fehlstellung) schliesst das Vorliegen einer Fraktur nicht aus.
Untersuchungen
- Prüfung der Fingersensibilität und Motorik, Puls und kapilläre Füllungszeit.
–> Die Beweglichkeit ist meistens schmerzbedingt eingeschränkt, wenn möglich sollte die Pronation sowie Supination, Flexion und Extension geprüft werden. Druckschmerz im Bereich der Tabatière ist ein Hinweis auf eine mögliche Begleitverletzung des Scaphoids - Da bei einem Sturz auf den ausgestreckten Arm auch das Radiusköpfchen mit verletzt sein kann, sollte der Ellenbogen der betroffenen Seite ebenfalls klinisch untersucht werden. Bei Verdacht auf eine Fraktur grosszügige Indikation für eine radiologische Kontrolle –> Aufnahme in 2 Ebenen (a. p. und lateral)
- Röntgenaufnahme für folgende Fragestellungen: Kontinuitätsunterbrechung im Bereich der Kortikalis? Vorliegen einer anatomischen (Fehl-)Stellung? Im Falle einer Fraktur, ob diese disloziert ist und/oder bis in das Gelenk reicht.
Therapie
- Viele distale Radiusfrakturen können konservativ behandelt werden
- Bei inadäquatem Trauma sollte eine Abklärung bezüglich Osteoporose erfolgen
- Indikationen für die Überweisung zum Chirurgen bzw. für einen umgehenden Repositionsversuch der Fraktur sind
- Offene Frakturen, Patienten mit neurologischen Ausfällen im Bereich der Hand oder Durchblutungsstörungen, welche auf die Fehlstellung durch die Fraktur zurückzuführen sind
- Beim gesunden jungen Patienten sprechen das Vorliegen folgender Kriterien für die Empfehlung zu einer operativen Therapie: Dorsale Trümmerzone, Verkürzung des Radius über 5 mm, Stufenbildung von über 2 mm
- Schwieriger sind die Fälle, in denen eine leichte bis mässige Dislokation vorliegt (Grenzfälle sind häufig). Bei der Entscheidungsfindung helfen das Alter des Patienten, Komorbiditäten, die berufliche Tätigkeit/der Belastungsanspruch an das Handgelenk, vorhergehende Traumata sowie der Wunsch des Patienten. Im Zweifelsfall sollte ein Chirurg/Orthopäde zu Rate gezogen werden.
Konservative Therapie
- Ruhigstellung des Vorderarmes mit Handgelenkseinschluss. Es gibt verschiedene Möglichkeiten, das Handgelenk ruhig zu stellen: Ist ein Patient sehr compliant und die Fraktur unkompliziert, kann eine Klettschiene angelegt werden, andernfalls ist ein Combicast oder eine Gipsschiene sinnvoll (s. Gipskatalog im Anhang)
- Liegt eine dorsale Trümmerzone vor, empfiehlt es sich, radiologische Stellungskontrollen durchzuführen, um ein weiteres Absinken der Fraktur frühzeitig zu bemerken und allenfalls doch auf eine operative Therapie zu wechseln (siehe Liste zur Behandlung von Frakturen, Tab. 2)
- Zusätzlich sollte anfänglich (nach ca. 5–7 Tagen) eine klinische Kontrolle stattfinden, um die Weichteile und die neurologischen Befunde zu überprüfen
- Nach 6 Wochen empfiehlt es sich ebenfalls eine Röntgenkontrolle durchzuführen. Zeigt sich eine ausreichende Konsolidierung, sollte die Ruhigstellung nach Möglichkeit aufgehoben werden, um ein Einsteifen im Handgelenk zu vermeiden. Je nach Beschwerden des Patienten ist frühzeitig mit Ergotherapie zu beginnen und der Patient regelmässig zu kontrollieren.
Komplikationen/Spätfolgen
- Bei sehr protrahiertem Verlauf muss immer an die Entstehung eines CRPS (Complex Regional Pain Syndrome) gedacht werden. Dieses gilt es so früh wie möglich zu behandeln!
- Persistierende Schwellneigung (kann oft bis zu Monaten nach der Fraktur bestehen und bedarf in der Regel keiner weiteren Therapie): Ist der Patient hierüber nicht aufgeklärt, kommt es häufig zu Verunsicherungen
- Bewegungseinschränkung: Wenn funktionell störend, kann Ergotherapie helfen
- Irritation und/oder Ruptur der Extensor pollicis longus Sehne
- Frühzeitige Arthrose.
3.2. Malleolarfrakturen
- Klassische Verletzung nach einem „Fehltritt“. Die meisten Verletzungen in diesem Bereich treten unimalleolär (meist lateralseits) auf, deutlich weniger bimalleolär und nur selten trimalleolär
- Ursächlich kommt es bei dem „Fehltritt“ meist zu einem Supinationstrauma und seltener zu einem Pronationstrauma.
Diagnostik
- I. d. R. typische Anamnese. Häufig kann der Patient den Fuss nicht oder nur noch teilweise belasten. Zudem kann eine deutliche Schwellung vorliegen +/– Hämatom. Deutliche Druckdolenz über dem medialen und/oder lateralen Malleolus. Immer auch die proximale Fibula untersuchen, um eine Maisonneuve-Fraktur nicht zu verpassen
- Bei einem Supinationstrauma kommt es typischerweise zu einer Distraktion im Bereich des lateralen Malleolus und dadurch zu einer ligamentären Verletzung oder zu einer Fraktur in diesem Bereich. Entscheidend für die Therapie ist die Höhe der Fraktur in Bezug auf das OSG. Mittels der Weberklassifikation wird die Frakturhöhe beschrieben.
Weber-A-Fraktur
- Die Fraktur liegt distal der Syndesmose, teilweise ist nur die Fibulaspitze betroffen, selten sind die Bandstrukturen verletzt. Das Gelenk an sich ist noch stabil, daher können Weber-A-Frakturen häufig konservativ therapiert werden (siehe Liste zur Behandlung von Frakturen, Tab. 2).
Weber-B-Fraktur
- Die Fraktur liegt auf Höhe der Syndesmose, dadurch ist meist die Syndesmose involviert und die Notwendigkeit für eine Operation muss gut geprüft werden
- Wenn eine Weber-B-Fraktur konservativ therapiert wird, sollte nach 1–2 Wochen eine radiologische Stellungskontrolle durchgeführt werden (s. a. Tab. 2 im Anhang).
Weber-C-Fraktur
- Die Fraktur liegt oberhalb der Syndesmose und gilt als instabil. Daher besteht in der Regel immer eine OP-Indikation, und eine Vorstellung bei einem Chirurgen ist zwingend.
Abbildung 1: Weber-A-Fraktur, Weber-B-Fraktur, Weber-C-Fraktur (von li. nach re.)
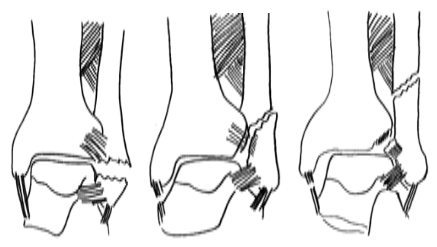
Eine Sonderform ist die Maisonneuve Fraktur, eine „Hohe Weber-C-Fraktur“: Fraktur des medialen Malleolus mit Zerreissung der Syndesmose und der Membrana interossea sowie eine proximale Fibulafraktur.
3.3. Kontusionen/Distorsionen (siehe auch medix Gl OSG-Distorsion)
- Durch Stürze oder andere Unfälle können Kontusionen und Distorsionen entstehen, welche gelegentlich sehr lange Beschwerden verursachen
- Kontusionen können teilweise extreme Schmerzen verursachen und stehen in Diskrepanz zu einem unauffälligen Röntgenbefund.
Hinweise zur Diagnostik und Therapie
- Patienten können aufgrund von ausgeprägten Schmerzen meist kaum untersucht werden –> Ausreichende Analgesie, nach ca. 5 Tagen erneute vollständige Untersuchung
- Insbesondere Patienten mit Kniedistorsionen berichten nach dieser Zeit meist bereits über eine deutliche Beschwerderegredienz
- Bei persistierenden Schmerzen, Instabilitätsgefühlen und Bewegungseinschränkungen sollte eine weitere Diagnostik mittels MRI in Erwägung gezogen werden.
- Eine initiale Ruhigstellung und Analgesie lindert in den meisten Fällen über den Verlauf von Tagen die Beschwerden deutlich. Jedoch können insbesondere Hüftkontusionen Schmerzen verursachen, welche teilweise über Wochen persistieren
- Patienten mit Kontusionen, welche nach 1 Woche noch immer über starke Schmerzen klagen, sollten – nach Frakturausschluss – frühzeitig zur Physiotherapie überwiesen werden sowie ausreichend Analgesie erhalten. Weiterhin kann ein MRI zur Ausschlussdiagnostik von Weichteilverletzungen dienen, wenn die Klinik entsprechend stark ausgeprägt ist
- Vorsicht bei einer Ruhigstellung über mehrere Wochen –> rascher Verlust des Bewegungsausmasses möglich (v. a. Ellenbogen, Schulter und Knie). Hier empfiehlt sich eher eine gute Analgesie sowie eine frühfunktionelle Nachbehandlung
- Bei Distorsionen kann anfänglich ebenfalls eine kurzzeitige Ruhigstellung erfolgen. Empfehlenswerter als die Ruhigstellung ist jedoch eine Entlastung zum Beispiel durch Unterarmstützen (Beispiel Kniedistorsionen).
3.4. Skidaumen (13–14)
- Läsion des ulnaren kapsulo-ligamentären Apparates, in einem Drittel der Fälle mit Ausriss eines Knochenfragmentes aus der Grundphalanxbasis
- Ohne korrekte Behandlung kann eine Gelenkinstabilität mit Einschränkung der Greiffunktion und im Endstadium eine Arthrose resultieren.
Anamnese
- Unfallhergang: Meist Hyperabduktion und Hyperextension im Metacarpophalangealgelenk des Daumens. Wichtige Fragen: Dominante/adominante Hand? Beruf? Frühere Unfälle?
Klinische Untersuchung
- Schwellung, Hämatom und oder Druckdolenz über dem MCP I ulnarseits. Aufklappbarkeit: Die Aufklappbarkeit sollte immer im Seitenvergleich geprüft werden. Häufig ist die Aufklappbarkeit initial aufgrund der Schmerzen jedoch nicht prüfbar
- Bei der Untersuchung der Aufklappbarkeit sollte der Daumen in etwa 30 ° flektiert gehalten werden: Eine Aufklappbarkeit über 30 ° bzw. eine Seitendifferenz von über 15 ° zur gesunden Seite sprechen für eine Komplettruptur des Kollateralbandes. Zusätzlich liegt meist ein fehlender Anschlag vor
- Röntgen: Konventionelles Röntgen in zwei (besser drei: lat./p.a./schräg) Ebenen mit der Frage, ob eine Fraktur bzw. ein ossärer Bandausriss vorliegt.
Prozedere und Behandlung
- Falls ein ossärer Ausriss bereits im konventionellen Röntgen vorliegt –> Zuweisung zur Handchirurgie
- Bei eindeutiger Aufklappbarkeit –> Zuweisung zur Handchirurgie
- Häufig bestehen starke Schmerzen, so dass eine Aufklappbarkeit nicht konklusiv beurteilt werden kann. Falls im Röntgen kein ossärer Ausriss vorliegt, kann die Hand zunächst für eine Woche ruhiggestellt werden (Handgelenksmanschette mit Daumeneinschluss) und anschliessend erneut untersucht werden
- Bei persistierend unklarem Befund –> Anmeldung MRI oder Zuweisung zur Handchirurgie
- Bei konservativer Therapie sollte eine Ruhigstellung für sechs Wochen erfolgen, nach 4 Wochen kann mit Ergotherapie aus der Schiene heraus begonnen werden, Belastungsaufbau nach 6 Wochen.
Sonderfall Stenerläsion
- Sonderfall der Komplettruptur: Durch ein Umschlagen des proximalen Bandanteiles nach proximal ist der Kontakt zum distalen Bandanteil nicht mehr vorhanden und verhindert die Spontanheilung. Daher wird bei einer vollständigen Ruptur meist die Operation empfohlen.
3.5. Traumatische (akute) Bursitiden (prä-/infrapatellär, Olecranon)
Ursachen
- In der Regel ein direktes Trauma, z. B. durch „Anschlagen“ des Ellenbogens/Sturz auf das Knie.
Klinischer Befund
- Das Leitsymptom ist die fluktuierende Schwellung über dem Olecranon bzw. prä- oder infrapatellär.
Diese kann teilweise sehr ausgeprägt sein. Schmerzen sind meistens, jedoch nicht immer vorhanden - Das Ellenbogengelenk/Kniegelenk kann in der Regel vollumfänglich bewegt werden, bei der Flexion beschreiben die Patienten teilweise ein Spannungsgefühl. Verbunden mit der passenden Anamnese kann die Diagnose in der Regel einfach gestellt werden
- Bei der Untersuchung muss insbesondere auf die Haut geschaut werden: Ist diese intakt? Besteht evtl. eine eröffnete Bursa?
Therapie
- Wichtigster Behandlungsschritt ist die konsequente Ruhigstellung. Mit einer Gipsschiene ohne Handgelenkseinschluss/Klettschiene sollte das Gelenk für ca. 7–14 d ruhiggestellt und spätestens nach 7 d erneut klinisch kontrolliert werden
- Zusätzlich können NSAR gegeben werden. Liegen eine über die Schwellung hinaus reichende Rötung, Überwärmung oder andere Infektzeichen vor, sollte eine antibiotische Therapie initiiert werden (Co-Amoxicillin 625 mg 3 x 1/d für 7–10 d).
- Eine Vorstellung beim Chirurgen sollte bei offener Bursa erfolgen sowie bei unter konservativen Massnahmen persistierenden oder zunehmenden Infektzeichen
- Häufig kann unter der konservativen Therapie eine Restitutio ad integrum erreicht werden. Eine Restschwellung kann über Wochen und sogar Monate persistieren und bedarf nicht zwingend einer chirurgischen Therapie
- Auf Punktionen sollte aus Gründen der Gefahr eines sekundären Infektes weitestgehend verzichtet werden
- Wenn immer möglich sollte eine Bursitis konservativ therapiert werden: Die Risiken für eine Wundheilungsstörung sind im Bereich des Ellenbogens/dem Knie nicht unerheblich.
3.6. Chronische Bursitiden (prä-/infrapatellär, Olecranon)
Ursache
- In der Regel nach repetitiven Belastungen durch Druck und Mikrotraumen. Gehäuft präpatellär bei Patienten mit kniender beruflicher Tätigkeit (Bodenleger, Sanitärmonteur etc.).
Klinischer Befund
- Meist seit längerer Zeit bestehende fluktuierende Schwellung, welche an Grösse variiert und inkonstant ist. Schmerzen bestehen in der Regel keine. Die Beweglichkeit ist nicht eingeschränkt. Gelegentlich zeigt sich in der seitlichen Röntgenaufnahme des Ellenbogens ein Knochensporn am Olecranon.
Therapie
- Solange die chronische Bursitis keine Schmerzen verursacht, ist eine chirurgische Therapie nicht zwingend notwendig. Da mit längeren Arbeitsausfällen von – bei gutem Verlauf – mindestens zwei Wochen gerechnet werden muss, erfordert eine operative Therapie eine gute Aufklärung über die Vor- und Nachteile bzw. die mit einer Operation verbundenen Risiken (Wundheilungsstörung, Rezidiv, Blutung, Infekt etc.)
- Kommt es zu einer Superinfektion kann zunächst ein konservativer Therapieversuch durchgeführt werden (s. o.). Bei rezidivierenden Infekten sollte eine operative Resektion erwogen werden.
4. Haut
Mögliche Eingriffe in der Hausarztpraxis
- Inzisionen von Abszessen
- Exzisionen von Naevi.
4.1. Inzision von Abszessen
- Abszesse können ubiquitär auftreten, kommen jedoch gehäuft axillär, inguinal und perianal vor. Auslösende Bakterien sind meistens „normale“ Hautkeime, welche durch kleinere Hautverletzungen (z. B. Rasur) den Schutzmantel der Haut durchdringen. Auch immunsupprimierte Patienten neigen zu Abszessen. Bei rezidivierenden Abszessen im Bereich der Axilla und Leiste sollte an die Diagnose einer Acne inversa und Hidradenitis suppurativa gedacht werden
- Klassische Symptome: Calor, Rubor, Dolor, Tumor, Functio laesa
- Im Prinzip gilt „ubi pus ibi evacua“. Eine Inzision führt häufig schon zu einer deutlichen Beschwerdebesserung.
Vorgehen
- Bei unkomplizierten Abszessen –> Inzision nach Hautdesinfektion und Lokalanästhesie (ggfls. ist auch Kryoanästhesie aufreichend): Mit dem Skalpell kann direkt über dem Prozess eine Stichinzision in Richtung der Spalthautlinien durchgeführt werden, bei sehr grossen Abszessen und im Bereich der Axilla kann eine Erweiterung der Wundöffnung mittels kleiner Spindelexzision sinnvoll sein
- Eine Abstrichentnahme ist in der Regel wenig sinnvoll und hat in den allermeisten Fällen keine Konsequenzen
- Nach Entleerung von Pus erfolgt eine Wundspülung mittels NaCl 0,9 % oder Ringerlösung. Anschliessend kann eine feuchte Kompresse in die Wundhöhle eingelegt werden. Der Patient sollte nun die Wunde täglich ausspülen. Aufwändige Wundverbände sind nicht nötig und führen häufig nur zu einer weiteren Hautirritation
- Antibiotikatherapie ist i. d. R. nur bei ausgedehntem Weichteilinfekt nötig, bei einfachen Abszessen keine routinemässige Antibiotikagabe!
Besonderes/Spezialfälle
- Abszesse über Gelenken, im Handbereich, perianal und im Gesicht sollten grosszügig dem Chirurgen zugewiesen werden
- Insbesondere im Fingerbereich (Panaritium) sollten nach einer Inzision eine Ruhigstellung (inklusive Handgelenk) und regelmässige Wundkontrollen folgen (cave: Phlegmone). Hier ist eine Therapie mit Antibiotika sinnvoll und empfohlen
- Bei Infekten über Gelenken sollte vor einer Inzision eine Mitbeteiligung des Gelenkes ausgeschlossen werden und nachfolgend ebenfalls eine kurzzeitige Ruhigstellung erfolgen
- Bei Abszessen, welche durch einen infizierten Sinus pilonidalis verursacht werden, sollte über dem Abszess (nach Möglichkeit mit etwas Abstand zum Porus) eine Stichinzision erfolgen und im weiteren Verlauf im entzündungsfreien Intervall eine Exzision des Sinus pilonidalis erfolgen (siehe Kap. 5.4.)
- Perianalabszesse sind in 90 % durch kryptoglanduläre Abszesse verursacht, in 10 % durch spezifische Ursachen, wie IBD (M. Crohn, Colitis ulcerosa), Traumata und vorhergegangene chirurgische Eingriffe. Bei rezidivierenden Abszessen muss immer an eine Fistel und eine chronisch infektiöse Darmerkrankung gedacht werden. Eine Abszessinzision ist aufgrund starker Schmerzen und z. T. tiefer Abszessausdehnung nicht in der Hausarztpraxis durchführbar –> an Chirurgen überweisen
- Abszesse im Gesicht können durch Infekte im Kieferbereich ausgelöst werden, was eine Vorstellung bei einem Kieferchirurgen nötig macht. Beachte: Manipulationen vermeiden (fehlende Blut-Hirn-Schranke oberhalb der Nasenwurzel!).
4.2. Exzision von Hauttumoren
Indikation
- Bei atypischen Prozessen, ggfls. zuvor Biopsie (Cave: Bei Verdacht auf Melanom primäre Totalexzision).
Kontraindikationen (absolute und relative)
- Grosse Exzisionen
- Schlecht abgrenzbare Tumore
- Rezidiv-Tumore
- Heikle Lokalisationen (Augennähe, Lippen, Ohren, Nase, Halsbereich, Risiko von Nervenläsionen etc.)
- Risikokonstellationen: Alter, Komorbiditäten, Antikoagulation (Pausieren der Antikoagulation liegt im Ermessen des Operateurs und ist nicht zwingend notwendig).
Antibiotikaprophylaxe
- Ist sehr selten indiziert und sollte nur durchgeführt werden bei Eingriffen an der Mukosa, superinfizierter Haut oder hohem Risiko eines Wundinfektes (Immunsuppression, Diabetes mellitus, zweizeitige Operationsverfahren)
- Für die Notwendigkeit einer postoperativen Antibiotika-Prophylaxe gibt es keine Evidenz
- Falls eine Antibiotikaprophylaxe nötig ist, sollte diese durch eine einmalige Gabe (Amoxicillin/Clavulansäure 875/125 mg, Clindamycin 600 mg oder Azithromycin 500 mg) 30–60 min vor der Operation erfolgen.
Desinfektion
- Wenn möglich alkoholhaltige Desinfektionsmittel, v. a. für seborrhoische Areale (mit gesteigerter Talgproduktion), z. B. Octeniderm®, Softasept®, Betaseptic®. Cave: Augennähe und bei Operation mit dem Elektrokauter (Augenreizung und Verbrennungsgefahr)
- Einwirkzeit mindestens eine Minute, bei talgdrüsenreicher Haut länger.
Lokalanästhesie
- Gut geeignet: Lidocain 1 % mit Epinephrin. Cave: Finger und Zehen (kein Epinephrin, Blutsperre anlegen)
- Nach Epinephringabe ist die maximale Vasokonstriktion nach 7 Minuten erreicht.
Schnittführung und Exzision
- Ziel ist der spannungsfreie Wundverschluss, eine unauffällige und schöne Narbe. Im Gesicht sollte die Narbe in Falten und im Bereich anatomischer Grenzlinien zu liegen kommen
- Bei einer Spindelexzision Längsachse parallel zu den Hautspaltlinien wählen und die Spindel genug lang planen (Winkel ≤ 30 °)
- Senkrechte Inzision mit dem Skalpell bis in die Subkutis und Freipäration der Spindelspitze, ggfls. Fadenmarkierung. Horizontale Präparation in der Subkutis
- Bei Exzisionen von Weichteiltumoren müssen die Prozesse nach Möglichkeit immer im Ganzen entfernt werden, um ein Rezidiv zu vermeiden
- Intraoperative Blutstillung mittels Kauter oder Ligaturen, guter Wundrandadaptation und Kompressionsverband: Der Wundverschluss erfolgt meist durch eine zweischichtige Naht. Nach einer Subkutannaht kann die oberflächliche Hautnaht mit einem dünnen Faden erfolgen. Einzelknopfnähte bieten den Vorteil, dass im Falle eines Infektes oder schlechter Heilung einzelne Nähte entfernt werden können
- Beim Wundverband sollte zunächst ein Pflaster und anschliessend ein Kompressionsverband aufgebracht werden.
Abbildung 2: Hautspaltlinien ventral und dorsal. An den Extremitäten verlaufen die Hautspaltlinien zwar quer, bei chirurgischen Eingriffen sollte die Schnittführung aber entsprechend dem Verlauf von Nerven, Gefässe, Sehnen etc. in Längsrichtung erfolgen (Abbildung: H. Scotland).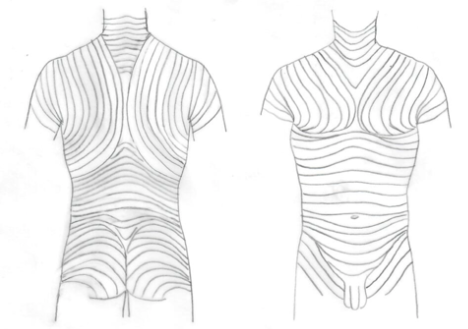
Postoperative Kontrollen
- Meist ist eine Bedarfsanalgesie ausreichend
- Häufig bedarf es bei unkomplizierten Wunden keiner regelmässigen Kontrollen vor der Fadenentfernung. Duschen und Kontakt mit Wasser und milden Seifen ist im Prinzip ab sofort erlaubt, Bäder (insbesondere in chlorhaltigem Wasser) sollten jedoch vermieden werden
- Bei Lappenplastiken oder heiklen Wunden kann nach 2 Tagen der erste Verbandwechsel erfolgen. Bei unauffälligem Verlauf kann ein gewöhnliches Pflaster aufgebracht werden
Fadenentfernung
- Gesicht: 5 Tage
- Behaartes Haupt: 7–14 Tage
- Rumpf und obere Extremität: 7–10 Tage
- Untere Extremität: 10–14 Tage
- Über Gelenken: 14 Tage.
4.3. Unguis incarnatus
Ursachen
- Oft mangelhafte bzw. falsche Fusspflege und/oder zu enges Schuhwerk, wodurch ein seitliches Einwachsen des Nagels in das Nagelbett begünstigt wird. Dadurch kommt es zu einer Fremdkörperreaktion mit nachfolgender sekundärer Entzündung.
Diagnostik
- Klinisch fast immer eindeutig: Meist ist die Grosszehe betroffen, das mediale und/oder laterale Nagelbett ist gerötet, sehr berührungsempfindlich und es kommt zu Eiter- und Blutaustritt auf Druck.
Therapie
Konservativ
- In der Regel ist keine chirurgische Intervention nötig
- Gute Aufklärung und Instruktion des Patienten: Die Nägel sollten horizontal geschnitten werden (nicht rund bis in das Nagelbett) und erst gekürzt werden, wenn sie über das Nagelbett herausragen
- In leichteren Fällen: Fussbäder mit Betadinezusatz 2–3 x/d. Alternativ: Antibiotikahaltige Salbe auftragen
- In akuten Fällen ev. Co-Amoxicillin p.o. für 7–10 d. Die Gabe von Antibiotika bei Rezidiven ist umstritten und in Studien nicht eindeutig als vorteilhaft belegt
- Meist lassen sich durch regelmässige podologische Behandlungen und das Tragen gut passender Schuhe die Ursachen und Beschwerden beheben. Hinweise an Patienten: Die Kosten werden häufig nicht von der Krankenkasse übernommen, und es ist Geduld gefragt, bis eine dauerhafte Besserung eintritt.
Operativ
- Bei frustraner konservativer Therapie und regelmässigen Rezidiven scheint die Nagelteilresektion der Kocher‘schen Teilresektion überlegen zu sein.
- Vorgehen
- Nach Desinfektion und Setzen einer Leitungsanästhesie nach Oberst und Anlage einer Blutsperre wird der eingewachsene Nagelanteil inklusive Nagelmatrix aus dem Nagelbett luxiert und gekürzt. Anschliessend wird das Nagelbett mit der Kürette gereinigt
- Nach Anlegen eines Druckverbandes mit Fucidin-Salbe (für 24–48 h belassen) kann der Patient täglich Fussbäder durchführen. Regelmässige Kontrollen nach chirurgischer Exzision (anfänglich 2 x/Woche).
5. Viszeralchirurgie
5.1. Leistenhernien
- Häufig werden Inguinalhernien und Femoralhernien zusammenfassend als Leistenhernien beschrieben. Inguinalhernien sind mit Abstand die am häufigsten auftretenden Hernien im Bereich der Bauchwand, Komplikationen machen hingegen häufiger Femoralhernien. Von den Leistenbrüchen sind 96 % inguinal, 4 % femoral gelegen
- Männer haben viel häufiger Leistenbrüche als Frauen.
Risikofaktoren für das Auftreten von Leistenhernien
- Frühere Leistenbrüche
- Hohes Alter
- Chronischer Husten
- Chronische Obstipation
- Rauchen
- Familiäre Belastung.
Allgemeine Klassifizierung
- Angeboren vs. erworben
- Direkt vs. indirekt vs. femoral (wobei die Unterscheidung zwischen Inguinal- und Femoralhernie wichtiger ist)
- Direkte Hernien liegen medial der epigastrischen Gefässe und verlaufen „direkt“ durch die Bauchdecke
- Indirekte Hernien liegen lateral der epigastrischen Gefässe, der Bruchsack zieht entlang des Samenstranges bzw. des Ligamentum rotundum (häufigste Form der Hernie)
- Femoralhernie: Unterhalb des Leistenbandes gelegen, medial der Femoralvene (häufiger bei Frauen).
Symptome/Diagnostik
- Häufig Schwellung an typischer Lokalisation, meist vergrössert unter Valsalva
- Belastungsabhängige Schmerzen, vermehrt beim Stehen, bei Erhöhung des intraabdominalen Druckes und häufig zum Ende des Tages verstärkt
- In der Regel kann die Diagnose klinisch gestellt werden. Falls kein eindeutiger Befund besteht, der Verdacht jedoch auf eine Hernie vorliegt –> Ultraschall, CT unter Valsalva oder MRI. Diese Untersuchungen sollten jedoch nur in Ausnahmefällen veranlasst werden. Cave Überdiagnostik!
Differentialdiagnose
- Ansatztendinopathie am Os pubis (immer prüfen!): Gehäuft bei jungen, sportlichen Männern, die Beschwerden können sehr hartnäckig sein. Therapieversuch mit Physiotherapie und Analgesie mit NSAR.
Inkarzerationsrisiko
- Insgesamt sehr niedrig (0,3–3 %); als Risikofaktoren gelten Alter, Femoralhernien sowie Rezidivhernien.
Therapie
- Die definitive Therapie besteht in der chirurgischen Versorgung
- Eine eindeutige Indikation für die Operation besteht bei Inkarzeration (Notfallzuweisung zum Chirurgen), bei mässiger bis starker Symptomatik mit Einschränkungen im Alltag, nicht reponiblen Hernien sowie neu aufgetretenen Femoralhernien
- Eine relative Indikation für eine chirurgische Versorgung liegt bei leichten oder fehlenden Beschwerden vor
- Im Falle einer Inkarzeration kann eine vorsichtige Reposition versucht werden und der Patient anschliessend für eine zeitnahe Operation dem Chirurgen zugewiesen werden.
Merke: Es ist kein Nachteil, bei asymptomatischen Hernien abzuwarten, da Komplikationen auch ohne Operation nur sehr selten auftreten.
Art der Operation
- In der Regel werden die Hernien heute mit Netzen versorgt
- Aktuell wird vorwiegend die laparoskopische Technik favorisiert, da postuliert wird, dass die Rekonvaleszenz kürzer ist als beim offenen Verfahren
- Eine klare Empfehlung für die offene Technik gibt es vorwiegend nach Voroperationen (Rezidivhernie nach laparoskopischer Netzeinlage) und wenn Kontraindikationen für Vollnarkose bestehen
- Die laparoskopische Technik wird bevorzugt bei beidseitigen Hernien, da beide Seiten über dieselben Operationszugänge versorgt werden können
- Operationsrisiken: Verletzung des Samenstranges, der Bauchorgane; postoperative Schmerzen, welche teilweise chronisch werden können; allgemeine Komplikationen wie Blutungen, Wundinfekte, Thrombose etc.
Nachbehandlung
- Arbeitsunfähigkeit postoperativ: 1 bis 2 Wochen, je nach körperlicher Belastung im Beruf
- Eine Belastung nach Massgabe der Beschwerden ist nach Netzeinlage i. d. R. unmittelbar postoperativ erlaubt, auf das Tragen schwerer Lasten muss also nicht zwingend verzichtet werden
- Schmerzen und ein Fremdkörpergefühl, welche über vier Wochen anhalten, sind nicht ungewöhnlich (v. a. bei jungen, sehr sportlichen Patienten) –> Erneute Zuweisung zum Operateur, wenn der Alltag stark eingeschränkt ist und/oder bei einem längeren Arbeitsausfall.
5.2. Bauchwandhernien (15–29)
Einteilung
- Hernien im Bereich der Bauchwand werden nach ihrer Lokalisation beschrieben. Zusätzlich kann unterschieden werden zwischen angeborenen und erworbenen Hernien
- Angeborenen Hernien sind eine Omphalocele und eine Gastroschisis
- Erworbenen Hernien kommen im praktischen Alltag häufiger vor. Dabei muss noch unterschieden werden zwischen primären Hernien, welche ohne vorgängigen chirurgischen Eingriff entstanden sind, und sekundären Hernien, welche als Folge von chirurgischen Eingriffen auftreten (Narbenhernien, Trokarhernien)
- Die erworbenen Bauchwandhernien treten in der Folge einer Schwächung der mechanischen Haltefunktion auf (welche aus Muskulatur, Sehnen und Bändern besteht). Eine genetische Veränderung in der Kollagenzusammensetzung begünstigt das Auftreten von primären Hernien, Wundinfekte nach Voroperationen begünstigen hingegen sekundäre Hernien
- Nach dem „Pascal-Prinzip“ entsteht eine Bauchwandhernie durch ein Ungleichgewicht zwischen intraabdominellem Druck und dem Gegendruck, welcher durch die Bauchwand gegeben wird. Ist der intraabdominelle Druck grösser als der Gegendruck, kommt es zu einem Reissen am schwächsten Punkt und somit zur Entstehung einer Bauchwandhernie. Sobald eine solche entstanden ist, vergrössert sich die Hernie kontinuierlich.
Klinisches Bild
- Kleine Hernien können völlig asymptomatisch sein und zufällig diagnostiziert werden. In den meisten Fällen berichten die Patienten von dem plötzlichen Auftreten einer Schwellung im Bauchbereich. Eine Erhöhung des intraabdominellen Druckes (z. B. durch Valsalva) kann den Befund verstärken
- Grössere Hernien können teils groteske Formen annehmen und stören in der Regel mechanisch. Zusätzlich wird die über dem Befund liegende Haut durch die extremen Spannungen sehr beansprucht
- Anamnestisch können häufig Risikofaktoren für eine Hernie identifiziert werden (z. B. Voroperationen).
Untersuchung
- Beurteilung des Befundes im Stehen und im Liegen
- Im Stehen sind die Befunde stärker ausgeprägt und die Lokalisation kann genau beurteilt werden
- Im Liegen hingegen kann geprüft werden, ob sich die Hernie spontan reponiert, manuell reponierbar ist oder nicht reponibel ist. Ist die Hernie reponibel, können die Bruchränder genau untersucht werden. Diese Information ist für die Wahl der Operationstechnik entscheidend
- Bei adipösen Patienten kann die Untersuchung erschwert bis unmöglich sein
- In vielen Fällen ist die klinische Untersuchung ausreichend zur genauen Bilanzierung der Hernie. Bei adipösen Patienten oder sehr ausgeprägten oder auch extrem kleinen Befunden, ist die CT-Untersuchung unter Valsalva zielführend.
Häufigste Differentialdiagnosen
- Rektusdiastase
- Bei der Rektusdiastase weichen die beiden Muskelstränge des langen Bauchmuskels im Bereich der Linea alba auseinander. Da die darunter liegende Faszie intakt ist, besteht keine eigentliche Bauchwandhernie. Meist treten Rektusdiastasen im Oberbauch auf, gehäuft bei adipösen Männern im mittleren Alter sowie jungen Frauen nach Geburten.
- Lipome
- Können in der Bauchdecke liegen und ähnlich wie Hernien imponieren. Sollte bei der klinischen Untersuchung sowie Anamneseerhebung kein eindeutiger Hinweis für eine Hernie bestehen –> Sonographie.
- Serome und Fadengranulome
- Können nach vorgängigen chirurgischen Eingriffen auftreten –> Sonographie diagnostisch hilfreich.
Weitere Bauchwandhernien
- Epigastrische Hernien
- Zwischen Nabel und Xyphoid gelegen. Meist fällt eine kleine Vorwölbung auf, die häufig nur ca. 1 cm Durchmesser hat. Inkarzerationen sind selten, und häufig handelt es sich (sofern Voroperationen durchgeführt wurden) um Trokarhernien.
- Nabelhernien
- Häufigste Form der Bauchwandhernie, meist in Zusammenhang mit Adipositas und Schwangerschaft. Sie sind leicht zu diagnostizieren und häufig ein Zufallsbefund. Wenn Umbilikalhernien keine Symptome machen, kann zugewartet werden.
- Spieghel Hernie (Hernie im Bereich der Linea semilunaris):
- Sehr selten, schwierig zu diagnostizieren. Wenn eine solche Hernie diagnostiziert wird, sollte sie chirurgisch versorgt werden.
Therapie
- Im Falle einer Operation ist der Durchmesser der Bruchlücke entscheidend: Liegt diese unter einem Zentimeter, kann ein Direktverschluss durchgeführt werden. Vorteil: Es wird kein Fremdkörper implantiert. Der Patient muss jedoch auf die hohe Rezidivrate hingewiesen werden
- Da der Patient nach einem Direktverschluss eine Erhöhung des intraabdominellen Druckes vermeiden muss (zum Beispiel durch Husten, schweres Heben etc.) eignet sich diese Methode nicht für Patienten, die in der Freizeit oder im Beruf körperlich stark beansprucht sind
- Bei Bruchlücken > 1 cm wird i. d. R. ein Netz implantiert. Dies kann sowohl offen als auch laparoskopisch erfolgen. Vorteil: Hohe Belastbarkeit. Nachteil: Patienten entwickeln häufiger Serome und Wundinfekte und klagen postoperativ über mehr Schmerzen.
Nachbehandlung
- Richtet sich nach der Operationsmethode und den entsprechenden Empfehlungen des Chirurgen
- Für mindestens 6 Wochen postoperativ sollte der Patient auf das Heben schwerer Lasten verzichten. Insbesondere bei Direktverschlüssen ist dies essentiell, um ein Rezidiv zu vermeiden.
5.3. Cholezystolithiasis/Cholezystitis/Gallenblasenpolypen
5.3.1. Cholezystolithiasis
- Gutartiges Leiden, jedoch eine der häufigsten und kostenträchtigsten gastroenterologischen Erkrankungen. Prävalenz: 10–20 % der Bevölkerung haben Gallensteine, wovon 60–80 % bei Diagnosestellung asymptomatisch sind.
Risikofaktoren für Gallensteine
- Weibliches Geschlecht
- Positive Familienanamnese
- Gravidität
- Adipositas
- Höheres Alter
- Forcierter Gewichtsverlust
- Diabetes mellitus
- Hochkalorische ballaststoffarme Kost
- Ciclosporin A.
5-F-Regel
- Female, fat, fertile, fourty, family.
Symptome
- Kolik oder dumpfe Oberbauchschmerzen im Anschluss an fettreiches Essen. Die Koliken dauern Minuten bis Stunden und sind im rechten Oberbauch lokalisiert mit Ausstrahlung in die Flanke oder rechte Schulter
- Die Beschwerden sind jedoch häufig schwierig von anderen funktionellen Oberbauchbeschwerden abzugrenzen und können von der Klinik her sehr unterschiedlich ausfallen.
Bildgebung
- Sonographie als Goldstandard.
Labor
- Cholestase- und Entzündungsparameter sind bei einer einfachen Gallenkolik meist im Normbereich
- Eine kurzzeitige Erhöhung des Bilirubins und der Transaminasen spricht für einen stattgehabten Steinabgang resp. bei persistierend hohen oder steigenden Stauungsparametern für ein Konkrement im Gallengang (Choledocholithiasis).
Komplikationen
- Biliäre Komplikationen sind Cholezystitis, Perforation, Empyem, Cholangitis, Choledocholithiasis, lithogene Pankreatitis
- Das Risiko für eine biliäre Komplikation beträgt nach einer Gallenkolik 1–3 % pro Jahr, bei asymptomatischen Trägern 0,1–0,2 %.
Indikation Cholezystektomie
- Eindeutige Indikation bei Patienten mit typischen Beschwerden
- Relative Indikation bei atypischen Beschwerden, die keinem anderen Organ zugeordnet werden können. Hierbei muss der Patient darauf hingewiesen werden, dass die Beschwerden auch nach einer Operation persistieren können
- Verfahren der Wahl für die Entfernung der Gallenblase ist die laparoskopische Cholezystektomie.
5.3.2. Akute Cholezystitis
Pathogenese
- Mechanische Obstruktion am Gallenblasenausgang. Meist findet sich ursächlich ein Konkrement im Infundibulum oder im Ductus zystikus.
Symptome
- Konstanter Schmerz im rechten Oberbauch, Krankheitsgefühl und Fieber.
Untersuchung
- Druckdolenz mit lokalem Peritonismus im rechten Oberbauch (Murphy-Zeichen). Liegt eine Vergrösserung der Gallenblase vor, kann diese häufig auch als Resistenz palpiert werden.
Diagnostik
- Sonographie: Die Gallenblase stellt sich häufig gross dar, die Gallenblasenwand ist verdickt und weist eine Dreischichtung auf. Steine oder Sludge lassen sich fast immer nachweisen, nur in ca. 5 % der Fälle lassen sich keine Steine nachweisen.
Therapie
- Laparoskopische Cholezystektomie ist die Behandlung der Wahl. Sie sollte so früh wie möglich erfolgen. Patienten mit früher Cholezystektomie haben eine kürzere Hospitalisationsdauer ohne eine höhere Mortalität oder Morbidität
- Ist eine Operation nicht gewünscht oder durchführbar, kann eine antibiotische Therapie eingeleitet werden. Anschliessend sollte die Cholezystektomie à froid erfolgen.
5.3.3. Gallenblasenpolypen
Pathologie
- Heterogene Gruppe von Veränderungen der Gallenblasenwand, v. a. Pseudotumore (Cholesterinpolypen, entzündliche Polypen), epitheliale Tumore (Adenome), mesenchymale Tumore. Maligne Gallengangspolypen sind meist Adenokarzinome.
Diagnostik
- Die meisten Gallenblasenpolypen verursachen keine Symptome und sind Zufallsbefund in der Abdomen-Sonographie. Die Unterscheidung von Steinen, Cholesterinpolypen, Adenomyomatose, Adenomen und deren Abgrenzung zu Karzinomen kann bei ähnlicher Echogenität und Morphologie schwierig sein.
Therapie
- Das Vorgehen bei Gallensteinpolypen richtet sich im Wesentlichen nach der Grösse der Polypen (31)
- Polyp + Gallensteine (auch asymptomatisch) = Cholezystektomie empfohlen wegen erhöhter Malignitätsgefahr
- Polyp > 2 cm = Fast immer maligne, daher immer Cholezystektomie
- Polyp 1–2 cm = Cholezystektomie empfohlen (erhöhtes Risiko für Malignität)
- Polyp 6–9 mm = Sonographische Kontrolle nach 6 Monaten, dann jährlich bei stabiler Grösse
- Polyp ≤ 5 mm = Sonographische Kontrolle nach einem Jahr, wenn von der Grösse stabil, kann man abwarten.
Hinweise zur sonographischen Diagnostik
- Gallenblasenpolypen sind durch Umlagern des Patienten während der Sonographie leichter von Gallenblasensteinen zu differenzieren
- Das Vorliegen von mehr als einem Polypen spricht gegen ein Adenom und für das Vorliegen von Cholesterinpolypen
- Wenn ein Polyp im Follow-up nicht mehr nachweisbar ist, handelte es sich wahrscheinlich um einen Pseudopolypen und weitere Kontrollen sind nicht indiziert.
5.4. Sinus pilonidalis
Synonyme
- Steissbeinfistel, Pilonidalzyste, Sakraldermoid.
Definition
- Chronische Entzündung im Bereich der Rima ani, typischerweise sichtbare Pori in der Rima ani.
Ursachen/Risikofaktoren
- Überreste des embryonalen Medullarkanals werden ursächlich verantwortlich gemacht. Haarwuchs scheint ein Risikofaktor zu sein. Weitere RF: Männliches Geschlecht, Alter zwischen 20 und 30 Jahren, dunkelhaariger Typ, Übergewicht, schlechte Hygiene, sitzende Tätigkeit sowie (fraglich) Traumata.
Therapie
- Bei asymptomatischen Patienten ohne Infektzeichen kann abgewartet werden
- Im Falle von chronischen/akuten Entzündungen: Exzision in toto wird angestrebt, allerdings nach Möglichkeit nicht im akuten Infekt.
–> Eine Exzision im akuten Infekt führt zu einer grösseren Wunde, dadurch zu einer längeren Heilungsdauer bis zum sekundären Wundverschluss, mehr Schmerzen, aufwändigeren Verbandwechseln und häufig zu langer Arbeitsunfähigkeit - Daher ist ein zweizeitiges Vorgehen in einer Infektsituation empfohlen
- Zunächst erfolgt eine Inzision des Abszesses (meist in Lokalanästhesie möglich). Dafür wird neben der Rima ani nach Setzen einer Lokalanästhesie eine Stichinzision durchgeführt und der Abszess drainiert. Der Patient soll anschliessend die Wunde täglich ausduschen. Eine zusätzliche Antibiotikatherapie ist nur bei ausgedehntem Weichteilinfekt notwendig
- Nach frühestens 3 Wochen kann dann, nach Abheilung der akuten Entzündung, eine minimal invasive Exzision erfolgen (ebenfalls häufig in Lokalanästhesie): Dafür wird der Porus mit einer Knopfkanüle intubiert und mit verdünntem Methylenblau angefärbt. Anschliessend Exzision des eingefärbten Gewebes knapp im Gesunden
- Nach dem Eingriff: Tägliche Verbandwechsel mit Ausduschen und Einlage von feuchten Kompressen. Der Befund muss regelmässig ärztlich kontrolliert werden
- Risikofaktoren für ein Rezidiv: Unsachgemässer Verbandwechsel, ein starkes Haarwachstum im Bereich des Wundrandes. Durch Laserepilation kann eine dauerhafte Heilung erreicht werden.
5.5. Weichteiltumore
- Häufig stellen sich Patienten vor mit einer störenden Raumforderung. In den allermeisten Fällen handelt es sich dabei um gutartige Tumore: Lipome, Fibrome, Atherome.
Diagnostik
- Bei Atheromen ist die Anamnese sowie der klinische Befund meistens ausreichend für die Diagnosestellung: Am Kopf oder am Rumpf gelegen, meist mit gut sichtbarem Porus
- Ausserdem berichtet der Patient von weissem Sekret („Eiter“), welches sich häufig exprimieren lässt und stinkt
- Fibrome sind ebenfalls in der Regel gut zu diagnostizieren: weich, häufig gestielt, schmerzlos und im Falle einer Neurofibromatose Recklinghausen multipel auftretend
- Lipome sind in den allermeisten Fällen gutartige Befunde, subkutan bzw. subfaszial gelegen, gehäuft am Nacken, dem Rücken sowie an den Extremitäten, können jedoch auch ubiquitär auftreten. Die Grösse variiert dabei sehr stark. Nachfolgend sind die Empfehlungen bezüglich des Vorgehens zur Abklärung und Behandlung gemäss Leitlinien des Swiss National Sarcoma Advisory Board (30) aufgeführt:
Welche Befunde sind verdächtig für Malignität?
- Befunde unter der Faszie
- Schnell wachsende Befunde > 3 cm
- Oberflächlich gelegene Befunde (epifaszial gelegen) > 3–5 cm.
Welches Vorgehen bei „klassischen“ Lipomen?
Epifaszial gelegen
- Bei Befunden < 5 cm kann eine Exzision geplant werden
- Befunde > 5 cm sollten mittels MRI verifiziert werden. Falls danach der Befund weiterhin unklar ist, sollte eine Biopsie folgen (Empfohlen wird die Überweisung an einen Sarkomspezialisten).
Subfaszial gelegen
- Biopsie empfohlen (Planung und Durchführung durch Spezialisten empfohlen).
Folgende MRI-Befunde erhöhen die Wahrscheinlichkeit für Malignität
- Tief gelegene, subfasziale Befunde
- Kontrastmittelaufnahme/Septen/non-fatty areas
- Alter > 60 J.
- Grösse > 10 cm
- Lokalisation an der unteren Extremität.
Bezüglich Exzision kleinerer Weichteiltumoren und postoperatives Management siehe Kapitel 4.
6. Literatur
- Danzer S (2012): Wundbeurteilung und Wundbehandlung. Arbeitsbuch für die Praxis. Kohlhammer Stuttgart.
- Universitätsspital Basel (2011): Leitlinie Wundmanagement.
- Dissemond J (2014): Chronische Wunden und Bakterien. Hautarzt, Springer. 65:10-14.
- O'Meara S, Al-Kurdi D, Ologun Y, Ovington LG, Martyn-St James M, Richardson R (2014): Antibiotics and antiseptics for venous leg ulcers. Cochrane Database.
- Läuchli S, et al. (2013): Unterschiedliche Abheilungsdauer und Häufigkeit der Hospitalisation bei Ulcus cruris verschiedener Ursachen. Hautarzt. Springer-Verlag Berlin Heidelberg.
- National Pressure Ulcer Advisory Panel, European Pressure Ulcer Advisory Panel und Pan Pacific Pressure Injury Alliance: Prevention and Treatment of Pressure Ulcers: Quick Reference Guide. Emily Haesler (Hrsg.). Cambridge Media: Osborne Park, Western Australia; 2014.
- Lammer E, Sauerbruch T: Mechanisms of disease: the genetic epidemiology of Gallbladder Stones. Nat Clin Pract Gastroenterology Heptal 2005:423-433.
- Neubrand M, et al.: Leitlinien der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten zur Behandlung von Gallensteinen. Z Gastroenterol 2000; 6:449-468.
- Eiff MP, Hatch RL, Calmbach WL: Carpal fractures. In: Fracture Management for Primary Care, 2nd ed, Saunders, Philadelphia 2003.
- Gutow AP: Avoidance and treatment of complications of distal radius fractures. Hand Clin 2005; 21:295.
- Andersen DJ, Blair WF, Steyers CM Jr, et al.: Classification of distal radius fractures: an analysis of interobserver reliability and intraobserver reproducibility. J Hand Surg Am 1996; 21:574.
- Bozentka DJ, Beredjiklian PK, Westawski D, Steinberg DR: Digital radiographs in the assessment of distal radius fracture parameters. Clin Orthop Relat Res 2002; 409.
- Madan SS, Pai DR, Kaur A, Dixit R: Injury to ulnar collateral ligament of thumb. Orthop Surg 2014; 6:1.
- De Monaco D, Stäuble Th.: Der Skidaumen: die akute Läsion des ulnaren Seitenbandes des Daumengrundgelenkes, Schweizerische Zeitschrift für «Sportmedizin und Sporttraumatologie» 50 (1), 17–19, 2002.
- Rutkow IM, Robbins AW: Demographic, classificatory, and socioeconomic aspects of hernia repair in the United States. Surg Clin North Am 1993; 73:413.
- Everhart JE: The burden of digestive diseases in the United States. NIH Publication No. 09-6443, US Department of Health and Human Services, Public Health Service, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases; Washington, DC: US Government Printing Office, 2008.
- McIntosh A, Hutchinson A, Roberts A, Withers H: Evidence-based management of groin hernia in primary care--a systematic review. Fam Pract 2000; 17:442.
- Bendavid R: Femoral hernias in females. Facts, figures and fallacies. In: Abdominal wall hernias, Springer, New York 2001. p.639.
- Rosemar A, Angerås U, Rosengren A, Nordin P: Effect of body mass index on groin hernia surgery. Ann Surg 2010; 252:397.
- Ruhl CE, Everhart JE: Risk factors for inguinal hernia among adults in the US population. Am J Epidemiol 2007; 165:1154.
- Robinson A, Light D, Kasim A, Nice C: A systematic review and meta-analysis of the role of radiology in the diagnosis of occult inguinal hernia. Surg Endosc 2013; 27:11.
- Zollinger RM Jr: An updated traditional classification of inguinal hernias. Hernia 2004; 8:318.
- Lundström KJ, Holmberg H, Montgomery A, Nordin P: Patient-reported rates of chronic pain and recurrence after groin hernia repair. Br J Surg 2018; 105:106.
- Schumpelick V, Treutner KH, Arlt G: Inguinal hernia repair in adults. Lancet 1994; 344:375.
- Gallegos NC, Dawson J, Jarvis M, Hobsley M: Risk of strangulation in groin hernias. Br J Surg 1991; 78:1171.
- Earle DB, McLellan JA: Repair of umbilical and epigastric hernias. Surg Clin North Am 2013; 93:1057.
- Rutkow IM: Demographic and socioeconomic aspects of hernia repair in the United States in 2003. Surg Clin North Am 2003; 83:1045.
- Murphy KP, O'Connor OJ, Maher MM: Adult abdominal hernias. Am J Roentgenol 2014; 202:W506.
- Fathi AH, Soltanian H, Saber AA: Surgical anatomy and morphologic variations of umbilical structures. Am Surg 2012; 78:540.
- Swiss Medical Advisory Board: Guidelines for bone & soft tissue tumors (mesenchyma, sarcomas) minimal workup requirements, 2016. Sarkom Kompetenz Board
- Wiles R, et al.: Management and follow-up of gallbladder polyps: Joint guidelines between the European Society of Gastrointestinal and Abdominal Radiology (ESGAR), European Association for Endoscopic Surgery and other Interventional Techniques (EAES), International Society of Digestive Surgery - European Federation (EFISDS) and European Society of Gastrointestinal Endoscopy (ESGE). Eur Radiol 2017; 27: 3856-3866.
7. Anhang
Tabelle 1: Verbandmaterial (1, 2)
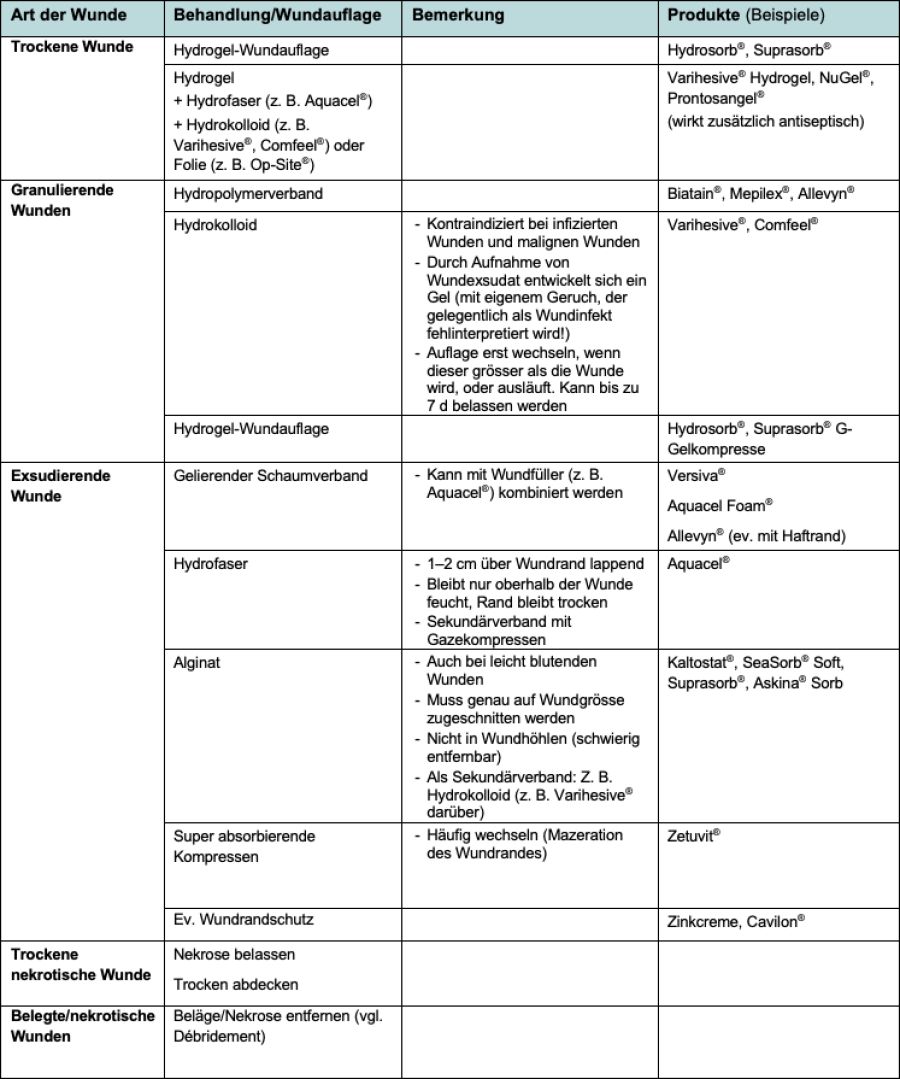

Tabelle 2: Frakturen – Kontrollen, Ruhigstellung/Belastung (in Anlehnung an die Therapieempfehlungen des Stadtspital Waid)
Für die Klassifikation von Frakturen (insbesondere an den Extremitäten) hat sich weltweit die AO-Klassifikation durchgesetzt. Die erste Ziffer beschreibt jeweils den betroffenen Knochen (1 = Humerus, 2R = Radius, 2U = Ulna, 3 = Femur, 4T = Tibia, 4F = Fibula), die zweite Ziffer bezieht sich auf die Lokalisation im entsprechenden Knochen (1 = proximal, 2 = diaphysal, 3 = distal). Als Drittes folgt ein Buchstabe, welcher den Frakturtyp beschreibt (A = einfach/extraartikulär, B = Keilfraktur/partiell intraartikulär, C = komplex/mehrfragmentär/artikulär), als Viertes folgt eine weitere Ziffer zur Beschreibung der Frakturschwere (1 = einfach, 2 = mittel, 3 = schwer).
Mittlerweile gibt es eine App, die bei der Einteilung der Frakturen helfen soll und bei Bedarf gratis geladen werden kann.
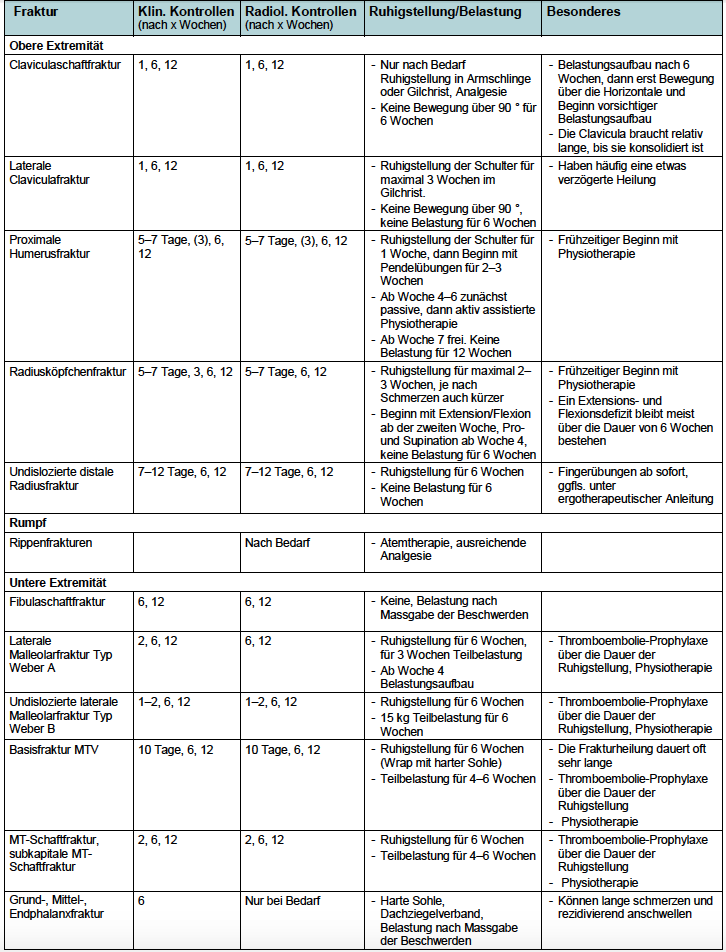
Anmerkung: Es werden bewusst nur die Behandlungsschemen für wenig bis undislozierte sowie unkomplizierte Frakturen aufgezeigt. Bei einer dislozierten oder intraartikulär gelegenen Fraktur sollte eine Überweisung zum Traumatologen erfolgen. Auf die Röntgenkontrolle nach 12 Wochen kann verzichtet werden, wenn der Patient beschwerdefrei ist und sich bereits in der Röntgenkontrolle nach 6 Wochen eine gute Konsolidation gezeigt hat.
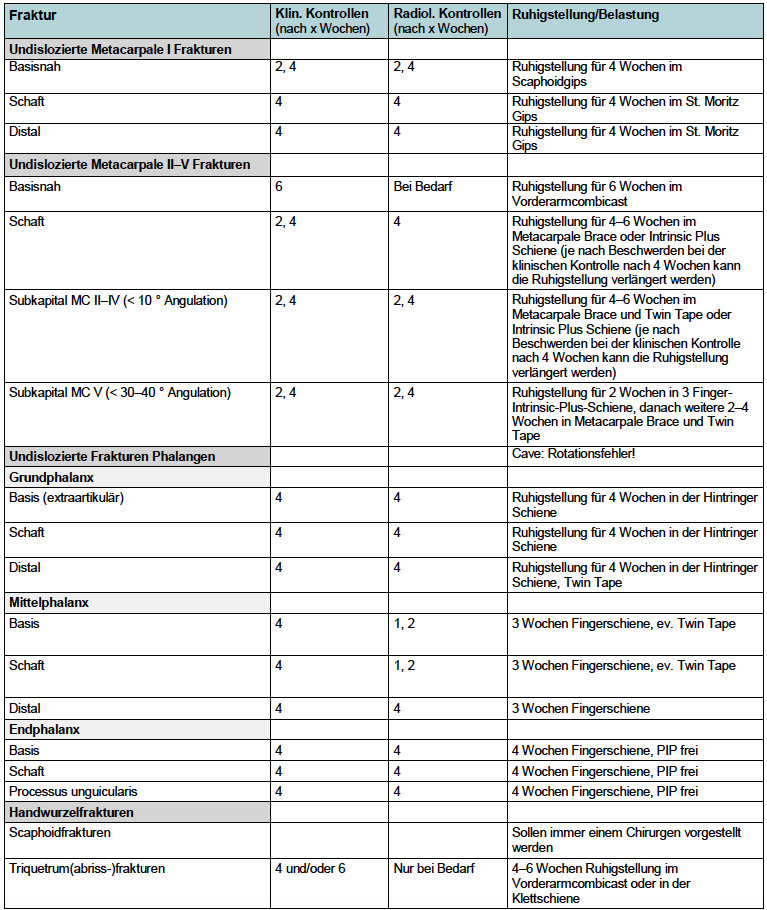
Tabelle 3: Frakturen im Handbereich – Kontrollen, Ruhigstellung/Belastung
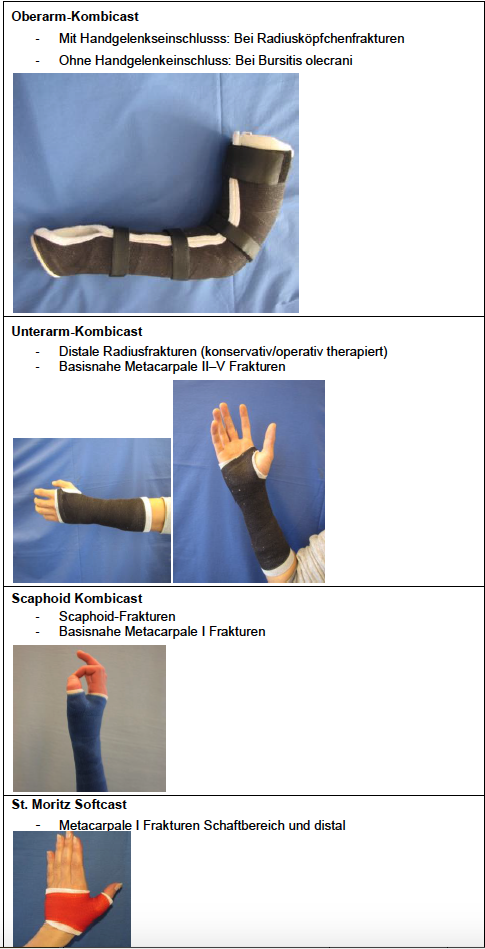
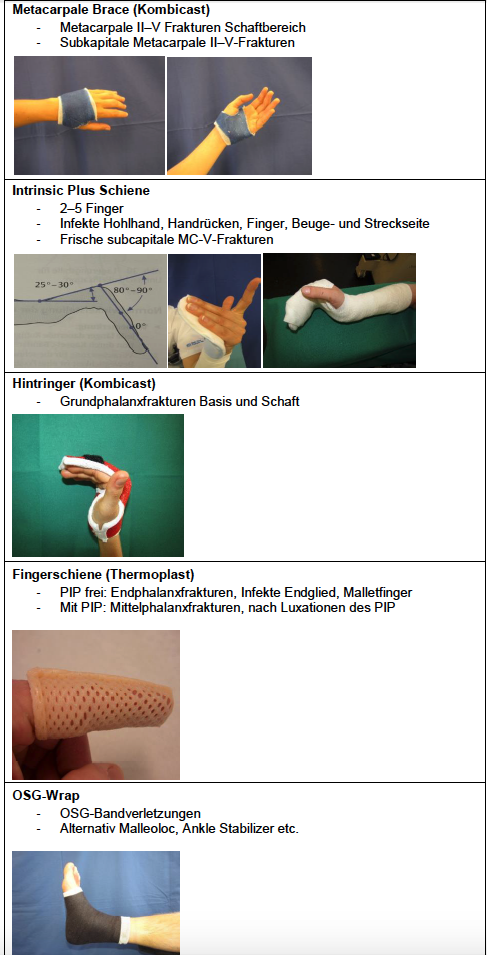
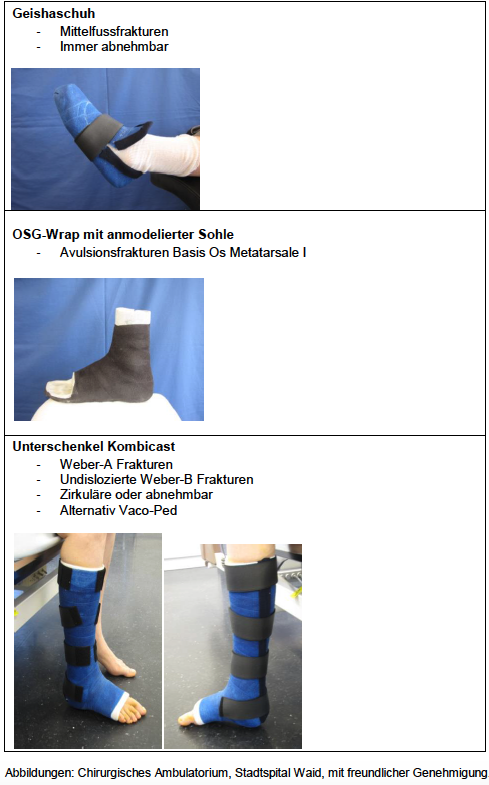
mediX Gipskatalog
8. Impressum
Diese Guideline wurde im September 2020 revidiert. Letzte Änderung: Mai 2023.
© Verein mediX schweiz
Herausgeberin
Prof. Dr. med. Corinne Chmiel
Redaktion
Prof. Dr. med. Corinne Chmiel
Dr. med. Felix Huber
Dr. med. Uwe Beise
Dr. med. Maria Huber
Autorin
Dr. med. Hella Scotland
Diese Guideline wurde ohne externe Einflussnahme unter Mitarbeit aller regionalen mediX Ärztenetze und assozierter Ärztenetze in der Schweiz erstellt Es bestehen keine finanziellen oder inhaltlichen Abhängigkeiten gegenüber der Industrie oder anderen Einrichtungen oder Interessengruppen.
mediX Guidelines enthalten therapeutische Handlungsempfehlungen für bestimmte Beschwerdebilder oder Behandlungssituationen. Jeder Patient muss jedoch nach seinen individuellen Gegebenheiten behandelt werden.
mediX Guidelines werden mit grosser Sorgfalt entwickelt und geprüft, dennoch kann der Verein mediX schweiz für die Richtigkeit – insbesondere von Dosierungsangaben – keine Gewähr übernehmen.
Alle mediX Guidelines im Internet unter www.medix.ch
Der Verein mediX schweiz ist ein Zusammenschluss von Ärztenetzen und Ärzten in der Schweiz.
Verein mediX schweiz, Sumatrastr.10, 8006 Zürich
Rückmeldungen bitte an: