Guideline
Osteoporose
Zuletzt revidiert: 07/2022 Letzte Änderung: 02/2023

Für PatientInnen
Mehr zu diesem Thema erfahren Sie in unseren Gesundheitsdossiers.
Aktualisierung 07/2022 und 02/2023
- Die Guideline wurde vollständig durchgesehen und aktualisiert
- Neu: Frakturrisiko-Einteilung und daraus abgeleitete Therapieempfehlungen (Kap. 3)
- Aktualisierung Abklärung auf sek. Osteoporose (Indikation/Laborparameter) (Kap. 2.5).
1. Grundsätze, Definition, Epidemiologie, Risikofaktoren
Zusammenfassung
- Das Frakturrisiko ist abhängig von Alter, BMI, stattgehabte inadäquate Frakturen, Polymedikation und Noxen, Komorbiditäten, Sturzgefahr, Familienanamnese und Knochendichte
- Das Frakturrisiko kann mittels FRAX® errechnet werden. Der Score wird primär ohne Densitometrie berechnet. Sollte auf Grund des FRAX ein begründeter Verdacht auf eine Osteoporose bestehen, kann eine Osteodensitometrie helfen, das Risiko verfeinert abzuschätzen
- Die Densitometrie misst nur den Mineralgehalt des Knochens und gibt keine Auskunft über die Knochenarchitektur. Sie erlaubt allein keine verbindliche Aussage zur individuellen Frakturgefährdung. Eine geringe Knochendichte ist für sich allein keine Indikation zur spezifischen Arzneimitteltherapie!
- Die postmenopausale Osteoporose ist eine Ausschlussdiagnose. Man sollte immer zuerst überlegen, ob es nicht eine andere Ursache gibt (sekundäre Osteoporose)
- Eine inadäquate Fraktur kann nach Ausschluss anderer Ursachen (Neoplasie) ohne Densitometrie Indikation für eine spezifische Behandlung sein
- Zusätzlich zu Osteoporosemedikamenten immer, wenn nicht ausreichend mit der Nahrung aufgenommen: Calcium/Vitamin D3 verordnen Rheumaliga: Calciumrechner (falls > 1‘000 mg keine Supplementation)
- Eine Behandlung soll erwogen werden bei Frauen ohne Fraktur, wenn das geschätzte 10-Jahresrisiko für eine osteoporotische Fraktur dem entsprechenden Risiko einer gleichaltrigen Person mit statgefundener Fraktur entspricht (Interventionsschwelle s. Tab. 1, Seite 6)
- mediX empfiehlt keine routinemässigen Verlaufsdensitometrien während einer Behandlung.
Definition
Die Osteoporose ist durch eine niedrige Knochenmasse und mikroarchitektonische Veränderungen des Knochengewebes charakterisiert. Daraus resultiert ein Anstieg der Knochenfragilität und die Neigung zu Frakturen. Sind bereits eine oder mehrere Frakturen als Folge der Osteoporose aufgetreten, liegt eine manifeste Osteoporose vor.
Epidemiologie und Risikofaktoren
- Die Prävalenz der Osteoporose auf Grundlage der WHO-Definition einer erniedrigten Knochendichte (DEXA T-Score < –2,5) beträgt bei
- Postmenopausalen Frauen: 50–60 J.: Ca. 15 %; > 70 J.: Ca. 45 %
- Männern: Prävalenz 50–60 J.: Ca. 2,4 %; > 70 J.: Ca. 15 %
- Das Frakturrisiko steigt mit zunehmendem Alter. Bei über 90-Jährigen kommt es bei 33 % der Frauen und bei 17 % der Männer zu einer Schenkelhalsfraktur
- Osteoporotische Frakturen betreffen v. a. die Wirbelkörper (WK), den distalen Radius und den proximalen Femur. Bei den WK-Frakturen bleiben ca. zwei Drittel asymptomatisch
- Frauen mit Wirbelkörperfraktur haben im Folgejahr in 19 % weitere Frakturen. Sie sind die Zielgruppe für die Sekundärprävention. Unbehandelt ist das Risiko 2 Jahre nach Erstfraktur am höchsten ("imminent fracture risk")
- Wirbelkörperbrüche treten manchmal unter Alltagstätigkeiten auf, bei älteren Personen sind sie aber oft sturzbedingt
- Etwa 70 % der älteren Männer und postmenopausalen Frauen, die eine Fraktur erleiden, weisen keine erniedrigte Knochendichte (T-Score < –2,0) auf.
Klinische Risikofaktoren, die mit einem signifikant erhöhten Frakturrisiko assoziiert sind

Bei singulärer, anteriorer Wirbelkörperfraktur 1. Grades nach Genant (20–25 % Höhenminderung) ohne Deckplattenimpression besteht kein erhöhtes Risiko für Folgefrakturen. Multiple Wirbelkörperfrakturen 1. Grades bzw. eine oder mehrere Frakturen 2. oder 3. Grades nach Genant (20–40 % bzw. > 40 % Höhenminderung) sind ein starker bis sehr starker Risikofaktor für osteoporotische Frakturen (bis > 10-fach erhöht), sofern keine anderen Ursachen für die Deformierung vorliegen.
Risikofaktoren für Stürze – unabhängig von der Knochendichte
- Ungenügende körperliche Aktivität
- Wiederholte Stürze
- Balance- und Gangstörungen
- Demenz
- Sehschwäche
- Erkrankungen, die zu kurzzeitigen Bewusstseinsstörungen führen können: TIA, Hypoglykämie, orthostatische Hypotonie, Herzrhythmusstörungen
- Generell schlechter Gesundheitszustand.
2. Diagnostik (2–10)
- Bei Vorliegen oder dem Verdacht auf eine manifeste Osteoporose
- Niedrigtraumatische Frakturen
- Verlust an Körpergrösse (Angabe in cm oder Tannenbaumphänomen der Haut)
- Zunehmender Rundrücken
- Akute oder chronische Rückenschmerzen, wenn keine andere Erklärung naheliegend.
- Bei Personen mit Risikofaktoren, die mit einem erhöhten Frakturrisiko assoziiert sind (Personen > 65 J.) (s. o.)
- Die Evaluation des 10-Jahres-Frakturrisikos erfolgt nach FRAX© (Schweiz). Für die Berechnung ist eine Densitometrie nicht zwingend notwendig, sie erhöht aber die Aussagekraft des Risikoscores –> FRAX® Schweiz
- Tipp: Tool mit differenziertem Ansatz (etwas zeitintensiver, aber man erhält eine direkte Empfehlung)
–> Osteorheuma.ch.
2.1. Anamnese
- Erhebung von Osteoporose-RF (s. o.) und Überprüfung, welche davon beseitigt/gemindert werden können
- Sturz-Risikoabklärung: Sturzanamnese, Medikation, Ernährung, Kognition, Orthostase (auch medikamentös), Visus, Mobilität, Kraft, Gang und Gleichgewicht, Schuhe, Ausdauer, Umgebung/Soziales.
2.2. Klinischer Befund
- Körpergrösse, -gewicht (Körpergrössenverlust > 3–4 cm ist ein Hinweis auf Osteoporose)
- Hinweise auf sekundäre Osteoporose, Malignom?
- Sturzrisiko ermitteln: Timed-up-and-go-Test, Chair-rising-Test bei eingeschränkter Kraft oder Koordination.
2.3. Bildgebung
- Wirbelkörperfrakturen werden mit BWS und LWS a/p und seitlich gesucht. Die Diagnose einer manifesten Osteoporose kann ohne das Vorliegen von Wirbelfrakturen mit dem Röntgenbild nicht gestellt werden.
Beachte: Frische Wirbelkörpereinbrüche sind röntgenologisch oft nicht eindeutig nachweisbar - Skelettszintigraphie bei Verdacht auf Malignom (bei V. a. Multiples Myelom zuerst CT).
2.4. Osteodensitometrie
Methode: DEXA (Doppel-Energie-Röntgen-Absorptionsmethode).
Messorte: Im Bereich der LWS, wobei im höheren Alter infolge degenerativer Veränderungen falsch hohe Werte resultieren können. Dies muss in der Beurteilung berücksichtigt werden, weshalb die Messung auf Höhe L1 bis L4 erfolgt und extrapoliert wird.
Sollte eine Beurteilung der LWS nicht möglich sein, kann die Osteodensitometrie am proximalen Femur vorgenommen werden. Zu beachten ist hierbei, dass es sich um einen kortikalen Knochen handelt, welcher – anders als beim Wirbelkörper – den Knochenverlust in der Spongiosa verdecken kann.
Bewertung
- Osteopenie: BMD* 1–2,5 SD unterhalb des T-Score-Mittelwertes
- Osteoporose: BMD < –2,5 SD unterhalb des T-Score-Mittelwertes
Beachte: Die Densitometrie misst nur den Mineralgehalt des Knochens. Sie erlaubt keine Aussage zur individuellen Frakturgefährdung. Eine geringe Knochendichte ist für sich allein keine Indikation zur spezifischen Arzneimitteltherapie!
Hinweis: Der T-Score entspricht der Anzahl der Standardabweichungen, die die Knochendichte des Patienten von der maximalen Knochenmasse eines gesunden, jungen Menschen mit gleichem Geschlecht und gleicher ethnischer Herkunft unterscheidet.
Der Z-Score entspricht der Anzahl der Standardabweichungen, die die Knochendichte des Patienten von einer Person des gleichen Alters und Geschlechts unterscheidet. Wenn der Z-Score ≤ –2,0 ist, ist die Knochendichte für das Alter des Patienten gering –> möglicher Hinweis auf sekundäre Ursachen für den Knochenverlust.
* BMD = Bone mineral density: g/cm2
Indikation für eine Densitometrie
mediX empfiehlt die Durchführung einer Densitometrie
Ohne Frakturereignis
- Kein allgemeines Screening (s. a. mediX GL Check-up), stattdessen „Case finding“ bei Frauen ab dem 65. Lebensjahr. Eine Indikation zur Densitometrie besteht, wenn das altersangepasste 10-Jahres-Frakturrisiko in der FRAX®-Berechnung (ohne Densitometrie) über der in Tabelle 1 (s. Seite 5) angegebenen %-Schwelle liegt
- Dauersteroidtherapie (> 7,5 mg Prednison-Äquivalent ≥ 3 Monate).
Beachte: Hier schon Behandlung ab T-Score –1,5 empfohlen!
Bei Frakturereignis
- Ermüdungsfrakturen, die nicht durch exzessive Aktivität erklärt werden können (das gilt nicht für Frauen < 65 J., die keine Risikofaktoren aufweisen)
- Frakturen nach inadäquaten Traumata oder spontane Wirbelkörperfrakturen
- Familiäre Osteoporose
- Essstörung (keine Kassenpflicht)
Hinweis: Bei Männern wird keine routinemässige Densitometrie (z. B. ab 70 Jahre) empfohlen. Bei Männern mit Risikofaktoren – z. B. Verlust an Körpergrösse > 3–4 cm, Langzeittherapie mit Steroiden, Hypogonadismus, primärer Hyperparathyreoidismus, Androgendeprivationstherapie bei Prostata-Ca – sollte jedoch eine FRAX©-Berechnung (+/- Densitometrie) erfolgen. Der Nutzen einer spezifischen Osteoporose-Behandlung ist bei Männern nicht umfassend belegt (9, 12, 24), die Therapieempfehlungen beruhen überwiegend auf den Studienergebnissen bei Frauen. Hormontherapien (Östrogene/Raloxifen) sind bei Männern nicht indiziert.
Wann Densitometrie-Kontrolluntersuchungen? (3)
- Bei Frauen ≥ 70 J. mit normaler DEXA: Keine weiteren Kontrolluntersuchungen erforderlich, ausser bei neu aufgetretenen Konstellationen, z. B. orale Steroidtherapie (11)
- Bei Frauen mit fortgeschrittener Osteopenie (T-Score –1,5 bis –2,0) und weiter bestehenden RF: Kontrolle nach 5 Jahren
- Bei einer laufenden spezifischen Therapie ist der Nutzen von Kontrollmessungen der Knochendichte nicht belegt. Ein Nichtanstieg der Knochendichte ist vor allem für die oralen Bisphosphonate und die SERMs (Selektive Östrogenrezeptor-Modulatoren; für die Osteoporosetherapie zugelassen ist Raloxifen) kein Hinweis für eine verminderte frakturreduzierende Wirkung! (3, 28, 29).
Knochendichtemessung und Grundversicherung
Nur DEXA wird bezahlt, und dies nur in einer Körperregion und nur bei folgenden Indikationen
- Klinisch manifeste Osteoporose
- Nach Knochenbruch bei inadäquatem Trauma
- Langzeit-Kortikosteroidtherapie
- Hypogonadismus
- Gastrointestinale Erkrankungen
- Primärer Hyperparathyreoidismus (sofern keine klare Operationsindikation besteht)
- Osteogenesis imperfecta
- Therapiekontrolle alle 2 Jahre (obwohl kein Nutzen belegt ist).
2.5. Labor (2)
Indikation
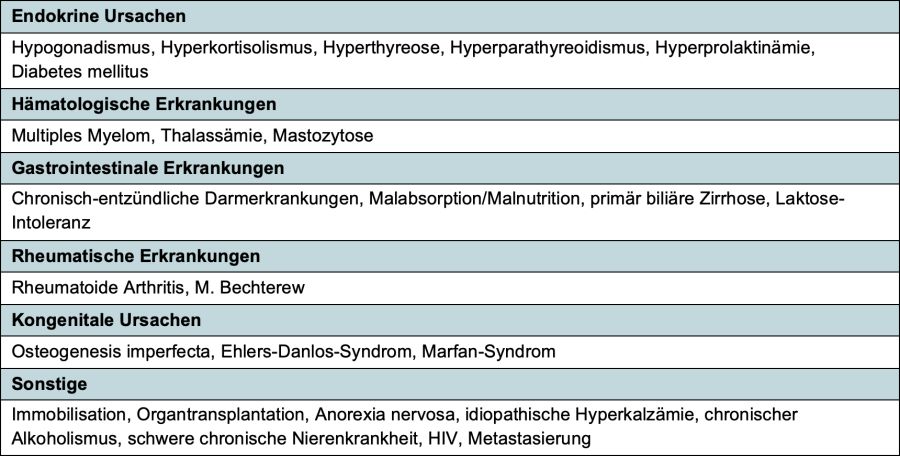
- Bei gesicherter Osteoporose (Fraktur oder nach pathol. DEXA) zum Ausschluss/Nachweis sekundärer Formen (–> Tabelle 2 im Anhang). Beachte: Die postmenopausale Osteoporose ist eine Ausschlussdiagnose!
An eine sekundäre Osteoporose sollte v. a. gedacht werden bei:
- Jüngeren Patienten
- Männern (in 80 % d. F.)
- BMD Z-Score < 2 SD
- Ungewöhnlichem Schweregrad
- Knochensubstanzverlust grösser als erwartet.
Laborparameter
- Serum-Calcium, Serum-Phosphat (nur falls Ca erhöht/erniedrigt: Parathormon und Vitamin D)
- Blutbild, CRP, Serum-Eiweisselektrophorese
- Alkalische Phosphatase (AP), Gamma-GT (GGT)
- Kreatinin und eGFR
- TSH
- Gesamt-Testosteron bei Männern mit Verdacht auf Hypogonadismus (–> mediX GL Sexualstörungen beim Mann)
Hinweis: Für die routinemässige Bestimmung von biologischen Markern gibt es derzeit keine Evidenz, weder diagnostisch noch zum Verlaufsmonitoring noch zum Entscheid, ob eine Therapie beendet werden kann.
3. Behandlung (1–4, 12, 13)
Prävention
Grundsätzlich sollen alle Frauen über die Primärprävention informiert sein
- Ausreichende Calciumeinnahme (1‘000 mg/d, Rheumaliga: Calciumrechner)
- Vitamin D 800 IE/d nur bei Risikokonstellationen (–> mediX GL Vitamin-D-Mangel), ausserdem ausreichend hohe Proteineinnahme
- Körperliche Bewegung mit Einsatz des Körpergewichts
- Nikotinabstinenz
- Mässigung beim Alkoholkonsum
- Information über Vermeidung von Stürzen –> stoppsturz.ch, Rheumaliga (Sturzprävention)
- Vorsicht beim Verordnen von Sedativa (vgl. Abschnitt 4).
Medikamentöse Therapie
Behandlungsempfehlung in Abhängigkeit vom Frakturrisiko
- Prävalente osteoporotische-Fraktur –> spezifische medikamentöse Therapie
- Periphere Fraktur nach Bagatelltrauma –> Bestimmung Frakturrisiko nach FRAX® oder T-Score ≤ –2
- Ohne Fraktur –> Altersadaptierte Interventionsschwelle (Tabelle 1).
Fraktur-Risiko-Einteilung
- Imminentes Frakturrisiko > 10 % Frakturrisiko in 2 Jahren
- Kürzlich erlittene Wirbelkörper- oder Schenkelhalsfraktur
- Alle MOF (major osteoporotic fractures) > 65 Jahre.
- Sehr hohes Risiko
- 10 Jahres Risiko einer MOF im FRAX Score 20 % > Interventionsschwelle in jedem Alter.
- Hohes Risiko
- Stattgehabte MOF +/- FRAX Score 10 Jahres Risiko > Interventionsschwelle, aber < 20 %
- Steroidtherapie, ablative Hormontherapie.
Tabelle 1: Risikoscore FRAX©: Alter, Frakturrisiko und Interventionsschwelle

Beachte: Vor Einleitung einer Behandlung soll immer eine Densitometrie gemacht werden. Liegt eine inadäquate Wirbelkörperfraktur vor, kann ev. auch darauf verzichtet werden. Für die Krankenkassen reicht die Diagnose einer Fraktur.
Medikamente
Grundsätze
- Individuell angepasst an das Alter, das Risiko und an Begleiterkrankungen
- Antiresorptive Therapie –> Bisphosphonate, Denosumab (Prolia®)
- Anabole Therapie (bone remodelling) –> Teriparatid (Forsteo®), Romosozumab (Evenity®)
- Beachte: Zusätzlich zu Osteoporosemedikamenten immer Calcium/Vitamin D3
1. Bisphosphonate
Generelles
- Haben als einzige medikamentöse Therapie eine Langzeitwirkung
- Alle Vertreter haben eine gute Wirkung auf alle Arten von Frakturen; Ausnahme: Ibandronat ohne Wirksamkeitsnachweis bezüglich Hüftfrakturen
- Für Frauen und Männer zugelassen
- Nicht bei GFR < 30 ml/min/1,73m2
- Oral: Geringe Bioverfügbarkeit
- Aufklärung der Patientinnen: Nach dem Aufstehen nüchtern mit Wasser einnehmen, 30 min in aufrechter Position auf das Frühstück warten. Währenddessen sollen keine anderen Medikamente, insbesondere kein Calcium, Kaffee oder Orangensaft getrunken werden, weil sonst die Resorption stark reduziert wird.
Wirksamkeit
- Number needed to treat (NNT): –> thennt.com.
Nebenwirkungen
- Kiefer-Osteonekrose: Inzidenz 0,001–0,01 % (bei onkologischen Patienten ist das Risiko wesentlich höher, da hohe Dosen, Inzidenz 1–15 %) (25). Patientinnen mit bekannten Zahnproblemen müssen vor Therapiebeginn zahnärztlich abgeklärt werden. Zahnchirurgische Eingriffe sollten vor Therapiebeginn stattfinden (16, 25), da z. B. invasivere Behandlungen wie Implantate unter Bisphosphonaten und Denosumab nicht einheilen
- Selten (3–50/100’000 Patientenjahre) atypische Femurfrakturen. Bei akut auftretenden Schmerzen in Leiste/Oberschenkel daran denken und Röntgen veranlassen! (15).
Kosten
- Alendronat (Alendronat® Helvepharm; Fosamax®) 70 mg/Woche (CHF 430.–/J.)
- Risedronat (Actonel®) 35 mg/Woche (CHF 360.–/J.)
- Zoledronat (Aclasta®, Generika): 5 mg/J. i.v. (CHF 310.–/J., ohne MPA-Kosten). Kurzinfusion 1 x/J.; bei erstmaliger Gabe ev. prophylaktisch ein NSAR oder Paracetamol zur Vermeidung von Myalgien und Fieber für 2–3 d geben. Patienten müssen auch gut hydriert sein (Crea-Clearance muss > 35 ml/min sein)
- Ibandronat (Bonviva®, Generika): 3-Monats-Spritze i.v. (CHF 260.–/J., ohne MPA-Kosten) oder 1 Monatstablette (CHF 344.–/J.).
2. Denosumab (Prolia®)
Generelles
- Humaner monoklonaler Antikörper gegen RANK*-Liganden (RANKL) gerichtet, der die Knochenresorption hemmt. So wirksam wie Bisphosphonate, möglich auch bei Niereninsuffizienz. Anwendung: Subkutane Injektion von 60 mg Denosumab alle 6 Monate
* RANK = Receptor Activator of Nuclear Factor Kappa B
- CAVE: Nach Absetzen ist mit einem bedeutenden Rebound-Effekt zu rechnen,
d. h. nach Therapieende folgt ein gesteigerter Knochenumbau mit Mineralgehaltsverlust. Die gewonnene Knochendichte kann innert wenigen Wochen bis Monate wieder verloren gehen, teilweise werden multiple Wirbelfrakturen erlitten. Nach Absetzen von Denosumab muss für mindestens 12–24 Monate eine Behandlung mit einem Bisphosphonat erfolgen! Es sind Studien im Gange, die allenfalls sogar eine längere Behandlungsdauer nach Absetzen untersuchen.
Wirksamkeit
- Number needed to treat (NNT): –> thennt.com.
Nebenwirkungen
- Kiefer-Osteonekrose, atypische Femurfrakturen (Häufigkeit wie bei Bisphosphonaten), Hypocalcämie (vor Therapiebeginn muss eine Hypocalcämie ausgeschlossen werden!), Hautreaktionen, Infektionen.
Therapiedauer
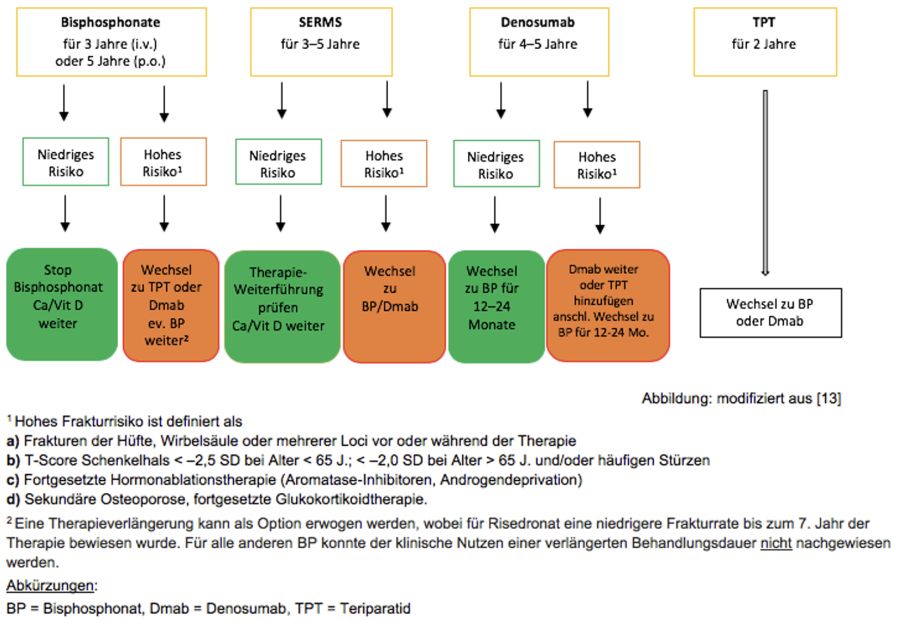
- 4–5 Jahre, anschliessend überprüfen –> individuell ist eine Fortsetzung bis zu 10 Jahren möglich.
Kosten
- CHF 600.–/ J.
3. Raloxifen (Evista®)
Generelles
- Selektiver Östrogenrezeptor-Modulator (SERM), weniger wirksam als Bisphosphonate oder Denosumab. Nur Wirkung auf Wirbelfrakturen! Bereits zur Prophylaxe zugelassen und von KK bezahlt (ab einem T- Score von < –1,0). Option nur für postmenopausale Frauen.
Wirksamkeit
- Number needed to treat (NNT): NNT/3 Jahre: 16 (bei vorbestehender osteoporotischer Fraktur); NNT/3 Jahre: 46 (bei Osteoporose ohne vorbestehende Fraktur) –> Einzelheiten s. MORE-Studie.
Nebenwirkungen
- Menopausenbeschwerden, erhöhtes Risiko für thromboembolische Ereignisse (Number needed to harm, NNH: 160)
- Raloxifen reduziert das Risiko Östrogenrezeptor-positiver Mammakarzinome.
Therapiedauer
- Nutzennachweis bis zu 8 Jahren.
Kosten
- CHF 420.–/Jahr.
4. Östrogene
Generelles
- Günstig, gute Wirkung auf alle Arten von Frakturen; sinnvoll, wenn auch starke Menopausebeschwerden bestehen
- Zur Osteoporose-Prophylaxe zugelassen sind Kombinationspräparate (z. B. Estrogen plus Dihydrogesteron/Norethisteron) und von KK bezahlt (ab einem T-Score von < –1,0)
- Knochenverlust nach Absetzen: Die Studien zeigen inkonsistente Ergebnisse, ein gravierendes Absinken der Knochendichte ist i. d. R. nicht zu erwarten (31).
Wirksamkeit
- Number needed to treat (NNT) –> ähnliche Wirksamkeit wie Bisphosphonate (32).
Nebenwirkungen
- Thromboembolien, Risiko für Mamma-Ca steigt.
Therapiedauer
- Zwischen 50. und 60. Lebensjahr bzw. so lange eine Indikation wegen Menopausebeschwerden besteht.
Kosten
- CHF 110–/Jahr.
5. Teriparatid (Forsteo®)
Generelles
- Ist ein rekombinantes humanes Parathormon-Fragment mit osteoanaboler Wirkung
- Die Indikationsstellung darf nur durch FachärztInnen (Endokrinologen, Rheumatologen) erfolgen. Second-Line-Therapie bei Versagen oder Unverträglichkeit der Antiresorptiva und in Spezialfällen.
Wirksamkeit
- Im Direktvergleich mit Risedronat senkt Teriparatid das Risiko für vertebrale Frakturen bei postmenopausalen Patientinnen mit schwerer Osteoporose signfikant (Vero-Studie). Eine Wirkung auf nicht vertebrale Frakturen ist nicht eindeutig nachgewiesen. Number needed to treat (NNT): 11–25.
Nebenwirkungen
- Gliederschmerzen (sehr häufig), Depression, Anämie, Myalgie, Arthralgie, Harndrang, Tachykardie, Emphysem (häufig) u. a.
- Kontraindikationen: Hypercalcämie, Schwangerschaft, schwere Niereninsuffizienz, metabolische Knochenkrankheiten, ungeklärte Erhöhung der Alk. Phosphatase, vorausgegangene Strahlenbehandlung, maligne Skeletterkrankungen.
Therapiedauer
- 2 Jahre. Nach Absetzen fällt die Mineraldichte schnell wieder ab (–> Anschlusstherapie mit BP oder Denusomab).
Kosten
- CHF 5‘400.–/Jahr.
6. Romosozumab (Evenity®)
Generelles
- Ist ein humanisierter monoklonaler Antikörper, der zu verstärktem Knochenaufbau führt und den Knochenabbau hemmt (–> verringerter Knochenumsatz)
- Die Indikationsstellung darf nur durch FachärztInnen (Endokrinologen, Rheumatologen) erfolgen (–> Spezialitätenliste).
Wirksamkeit
- In der ARCH-Studie reduzierte Romosozumab das Risiko klinischer Frakturen (vertebrale und nicht vertebrale) im Vergleich zu Alendronsäure nach 12 Monaten (3,9 vs. 5,4 %) und nach 33 Monaten (9,7 vs. 13,0 %). Der Zusatznutzen der neuen Therapie ist umstritten (-> AkdÄ).
Number needed to treat (NNT/Jahr): 77 (Verhinderung gescreenter Frakturen – vertebral und nicht vertebral –> Einzelheiten s. FRAME-Studie; NNT: 26 (verhinderte Wirbelfrakturen im Vergleich mit Alendronattherapie –> Einzelheiten s. ARCH-Studie.
Nebenwirkungen
- Nasopharyngitis, Arthralgien (sehr häufig); Überempfindlichkeitsreaktionen, Sinusitis, Kopfschmerzen, Muskelkrämpfe (häufig); Kieferosteonekrosen (selten), Risikofaktoren sind schlechte Mundhygiene, Parodontitis, invasive Zahnbehandlung, Begleittherapie mit Kortokosteroiden, Chemotherapie, Strahlentherapie
- Beachte: Der Verhinderung klinisch relevanter Frakturen steht ein potenziell erhöhtes kardiovaskuläres Risiko unter der Therapie entgegen. In der ARCH-Studie erlitten im ersten Jahr 2,5 % der Patientinnen unter Romosozumab ein schwerwiegendes kardiovaskuläres Ereignis (Herzinfarkt, Schlaganfall) vs. 1,9 % unter Alendronsäure. Bei Patientinnen nach Herzinfarkt und Schlaganfall ist das Medikament kontraindiziert. Auch Patientinnen mit bereits bestehenden kv Risikofaktoren sollten kein Evenity® erhalten.
Therapiedauer
- 1 Jahr; anschliessend Rebound-Effekt –> Umstellung auf Denosumab oder BP.
Kosten
- CHF 7‘222.–/Jahr (!).
Medikamentenwahl
Therapiewahl bei Patientinnen mit moderatem und hohem Risiko
1. Wahl
- Bisphosphonate (v. a. Alendronat, Risedronat).
2. Wahl
- Denosumab bei Unverträglichkeit oder Kontraindikation von/für Bisphosphonate. Nur fürältere Patienten –> Begründung: Sind Bisphosphonate kontraindiziert, kann die Behandlung nur mit Denosumab (oder Teriparatid) weitergeführt werden. Es erscheint aber nicht ratsam, dies über einen Zeitraum von mehr als 10 Jahre zu tun
- Raloxifen (bei jüngeren Frauen postmenopausal).
Bei Therapieversagen
- Teriparatid ist eine Option, nach 2 Jahren müsste aber erneut umgestellt werden. Wir empfehlen, die PatientInnen wegen möglicher Rebound-Effekte einem Facharzt/einer Fachärztin zuzuweisen.
Schmerzhafte Wirbelkörperfrakturen
- Bisphosphonate wirken erst nach 3–6 Monaten (etwas) schmerzreduzierend
- Calcitonin 200 IU nasal ist rascher wirksam. Therapiedauer: 2–4 Wochen
Hinweis: Keine Langzeitanwendung von Calcitonin bei Männern wegen erhöhtem Prostatakarzinomrisiko (14).
Eine Übersicht über die verschiedenen Therapieoptionen je nach Schwere der Osteoporose zeigt nachfolgende Abbildung:
Abbildung: Modifizierte Therapieempfehlungen der SVGO (2020)
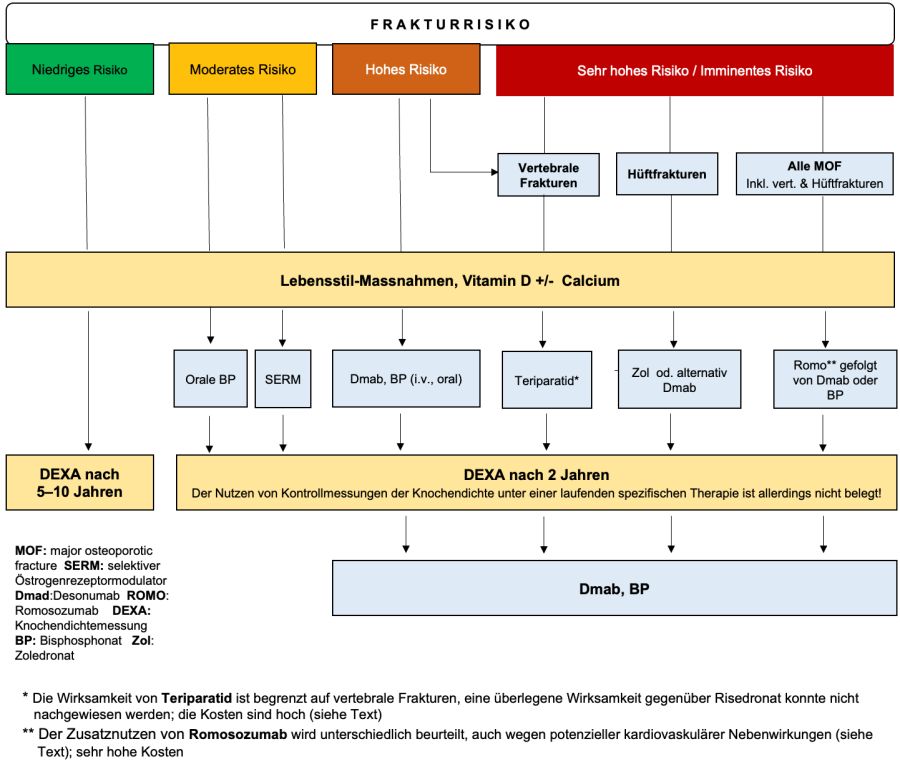
Wie lange soll behandelt werden? (13, 15–19)
4. Sturzprophylaxe (2, 3)
Neben der Osteoporose ist die allgemeine Sturzanfälligkeit sehr bedeutend für die Risikoabschätzung, eine Fraktur zu erleiden.
Das Frakturrisiko wird durch verschiedene ossäre und extraossäre Faktoren beeinflusst. Die wichtigste Prävention ist die Verhinderung von Stürzen.
Massnahmen (s. a. www.stoppsturz.ch)
- Reduktion des Sturzrisikos durch Überprüfung des häuslichen Milieus (Stolperfallen in der Wohnung, Beleuchtung, Schuhwerk)
- Geh- und Koordinationstraining
- Vermeiden von Immobilität
- Überprüfung des Gebrauchs und der Indikation sedierender, orthostatisch wirkender Medikamente sowie solcher mit Einfluss auf den Knochenstoffwechsel (Steroide, Antiepileptika, suppressive Schilddrüsenhormontherapie u. a.)
- Visuskorrektur
- Allenfalls Substitution von Calcium 500–1‘000 mg plus Vitamin D3 800 IU bei im Alters-/Pflegeheim lebenden Personen. Die Evidenz dazu ist jedoch schlecht (21) (–> mediX GL Vitamin-D-Mangel)
Hinweis: Der Nutzen einer generellen Vitamin D-Supplementierung oder einer gezielten Supplementierung von Vitamin D bei Serum-25-OH-Vitamin D < 20 ng/ml (50 nmol/l) ist bei Personen ohne ein hohes Fraktur- oder Sturzrisiko nicht belegt (22). Hochdosistherapien (z. B. Einmalgaben von Vitamin D3 500’000 IU) erhöhen das Sturz- und Frakturrisiko! (23) - Verschreibung von Gehhilfen
- Hüftprotektor: Nutzen unklar; wahrscheinlich Senkung der Femurfrakturrate, jedoch schlechte Akzeptanz bei Patientinnen (30).
5. Literatur
- Looker AC, et al.: Prevalence of low femoral bone density in older U.S. adults from NHANES III. J Bone Miner Res 1997; 12(11): 1769-71.
- Osteoporose: Prävention-Diagnostik-Behandlung. Empfehlungen der Schweizerischen Vereinigung gegen die Osteoporose SVGO, 2015. SVGO 2010.
- DVO Leitlinie:Prophylaxe, Diagnostik und Therapie der Osteoporose, 2017.
- Compston J, et al.: National Osteoporosis Guideline Group: Guideline for the diagnosis and management of osteoporosis in postmenopausal women and men from the age of 50 years in the UK. Updated March 2014. Sheffield 2014.
- Prophylaxe, Diagnostik und Therapie der Osteoporose bei Männern nach dem 60. Lebensjahr und bei postmenopausalen Frauen. S3-Leitlinie des Dachverbands der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e.V., Entwurf 2014. DVO 2014.
- Lehmann T, et al.: Frakturprädiktion – nicht nur eine Frage der Knochendichte. Schweiz Med Forum 2013;13(45):913–916.
- Rizzoli R, et al.: Osteoporose: von der osteodensitometrischen Diagnose zur Evaluation des absoluten Frakturrisikos. Schweiz Med Forum 2010;10(6):111–113. Swiss Medical Forum 2010.
- Osteodensitometrie bei primärer und sekundärer Osteoporose. IQWIG Abschlussbericht 2010. IQWiG 2010.
- Viswanathan M, et al.: Screening to Prevent Osteoporotic Fractures. Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. 2018;319(24):2532-2551.
- Meier C, Kraenzlin ME: Neue Wege in der Diagnostik und Therapie der Osteoporose. Schweiz Med Forum 2011;11(3):25–28.
- Gourlay ML, et al.: Bone-Density Testing Interval and Transition to Osteoporosis in Older Women: N Engl J Med 2012, 366: 225. NEJM 2012.
- Crandall CJ: Treatment To Prevent Fractures in Men and Women With Low Bone Density or Osteoporosis: Update of a 2007 Report. Agency for Healthcare Research and Quality U.S. Department of Health and Human Services. March, 2012. NCBI 2012.
- Meier C, et al.: Empfehlungen der Schweizerischen Vereinigung gegen Osteoporose (SVGO/ASCO): MedikamentöseOsteoporosetherapie: Behandlungsdauer und Vorgehen nach Therapieende. Schweiz Med Forum 2017;17(41):873-877. DOI:SVGO/ASCO 2017.
- EMA recommends limiting long-term use of calcitonin medicines. Pressemitteilung vom 20. Juli 2012. EMA 2012.
- Zur Dauer der Therapie mit Bisphosphonaten bei Osteoporose. a-t 2013; 44: 88, 93. AT 2013.
- Khnan AA, et al.: Diagnosis and management of osteonecrosis of the jaw: a systematic review and international J Bone Miner Res. 2015;30(1):3.
- Black DM, et al.: Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006 Dec 27;296(24):2927-38.
- Black DM, et al.: The effect of 3 versus 6 years of Zoledronic acid treatment of osteoporosis: A randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012;27(2):243–254. JBMR 2012.
- Fraser LA, et al.: Fracture risk associated with continuation versus discontinuation of bisphosphonates after 5 years of therapy in patients with primary osteoporosis: a systematic review and meta-analysis. Ther Clin Risk Manag. 2011; 7:157-66. Epub 2011 May 9.
- Balzer K, et al.: Sturzprophylaxe bei älteren Menschen in ihrer häuslichen Umgebung. DIMDI 2012.
- Chapuy MC, et al.: Effect of calcium and cholecalciferol treatment for three years on hip fractures in elderly women. BMJ. 1994 Apr 23;308(6936):1081-2.
- Snijder MB, et al.: Vitamin D Status in Relation to One-Year Risk of Recurrent Falling in Older Men and Women. J Clin Endocrinol Metab. 2006 Aug; 91 (8):2980-5. Epub 2006 May 9.
- Sanders KM, et al.: Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA. 2010 May 12;303(18):1815-22.
- Sim LW, Ebeling PR: Treatment of osteoporosis in men with bisphosphonates: rationale and latest evidence. Ther Adv Musculoskelet Dis. Oct 2013; 5(5): 259–267. NCBI 2013.
- Khan AA, et al.: Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus. J Bone Miner Res.2015 Jan;30(1):3-23.
- Rosen HN, Drezner MK: Clinical manifestations, diagnosis, and evaluation of osteoporosis in postmenopausal women. UpToDate, aufgerufen 06/2022.
- Yu EW: Screening for osteoporosis in postmenopausal women and men. UpToDate, aufgerufen 06/2022.
- Delmas PD, Seeman E: Changes in bone mineral density explain little of the reduction in vertebral or nonvertebral fracture risk with anti-resorptive therapy. Bone. 2004; Apr;34(4):599-604.
- Crandall CJ, et al.: Serial Bone Density Measurement and Incident Fracture Risk Discrimination in Postmenopausal Women. JAMA Intern Med 2020 Sep 1;180(9):1232-1240.
- Santesso N, et al.: Hip protectors for preventing hip fractures in older people. Database Syst Rev 2014 Mar 31;(3):CD001255.
- Papadakis G, et al.: The Benefit of Menopausal Hormone Therapy on Bone Density and Microarchitecture Persists After its Withdrawal. J Clin Endocrinol Metab. 2016 Dec;101(12):5004-5011.
- Ravn P, et al.: Alendronate and estrogen-progestin in the long-term prevention of bone loss: four-year results from the early postmenopausal intervention cohort study. A randomized, controlled trial. Ann Intern Med. 1999;131(12):935.
6. Anhang
Tabelle 2: Erkrankungen, die zu einer sekundären Osteoporose führen können
7. Impressum
Diese Guideline wurde im Juli 2022 aktualisiert. Letzte Änderung: November 2022.
© Verein mediX schweiz
Herausgeber
Prof. Dr. med. Corinne Chmiel
Redaktion
Dr. med. Uwe Beise
Dr. med. Felix Huber
Dr. med. Maria Huber
Autoren
Prof. Dr. med. Corinne Chmiel
Dr. med. Susanne Valentin
Dr. med. Uwe Beise
Dr. med. Felix Huber
Rückmeldungen bitte an:
Diese Guideline wurde ohne externe Einflussnahme erstellt. Es bestehen keine finanziellen oder inhaltlichen Abhängigkeiten gegenüber der Industrie oder anderen Einrichtungen oder Interessengruppen.
mediX Guidelines enthalten therapeutische Handlungsempfehlungen für bestimmte Beschwerdebilder oder Behandlungssituationen. Jeder Patient muss jedoch nach seinen individuellen Gegebenheiten behandelt werden.
mediX Guidelines werden mit grosser Sorgfalt entwickelt und geprüft, dennoch kann der Verein mediX schweiz für die Richtigkeit – insbesondere von Dosierungsangaben – keine Gewähr übernehmen.
Der Verein mediX schweiz ist ein Zusammenschluss von Ärztenetzen und Ärzten in der Schweiz.
Verein mediX schweiz, Sumatrastr. 10, 8006 Zürich.